科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-17
烯丙基是一种官能团,结构式为:H2C=CH-CH2-。在化合物中加入烯丙基基团后能产生新的带有烯键的化合物,使原化合物理化性质彻底改变,化合物的烯丙基化广泛应用于有机和药物合成,如具有广泛生物活性的光学活性α-氨基膦酸酯衍生物的合成。另外,-CH=CH-CH3 叫正丙烯基(系统命名叫1-丙烯基) —CH2-CH=CH2叫正烯丙基(系统命名叫2-丙烯基)。
应用芳香化合物的选择性官能化反应是一类重要的有机合成反应,一直受到药物研发、材料科学和精细化工等领域的广泛关注。其中,芳烃的烯丙基化反应所制得的烯丙基芳香化合物可以作为天然产物和生物活性分子的结构骨架或者反应中间体,如黄樟素就是烯丙苯的衍生物。此外,烯丙基可以进一步发生多类化学反应,如氧化反应、复分解反应、偶联反应及亲电取代反应等。
近几十年来,对芳烃进行烯丙基化的方法主要有三种:Friedel-Crafts烷基化反应、过渡金属催化的交叉偶联反应和芳环sp2碳-氢键活化反应。其中,Friedel-Crafts烷基化反应作为经典的烷基苯类化合物制备方法,己在工业上广泛使用。然而,该方法存在酸催化剂后处理复杂、底物要求富电性、反应温度高、区域选择性差及易发生过度反应等不足。随着时间的推移,过渡金属催化的交叉偶联反应以其高度区域和立体选择性等优点成为近年来研究热点,是构筑碳。碳键的重要方法之一。然而,该方法不仅原子经济性较差,在环境友好方面也存在不足。现如今,芳烃sp2碳。氢键活化反应作为一个原子经济性好、区域选择性高的新方法受到广泛关注,在某种程度上给交叉偶联反应带来了一定的冲击。但定位基的引入会限制底物的适用范围,如何将定位基移除或者转换是该方法需要面临的问题。
众所周知,许多天然产物通常具有高的生物活性和药用价值,因此市场需求量较大。然而,天然产物在自然界中的含量稀少,提取困难,让人们甚是苦恼。因此,通过化学方法来合成这些天然产物已经成为攻克此难题的必要途径1。
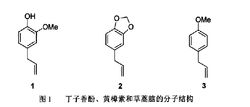
实际应用某些烯丙基芳烃因其宜人的气味而被应用于香精香料行业。丁子香酚(图1 化合物1)在自然界中主要由丁香的花蕾经干燥蒸馏所得,具有抗菌、降血压、调制成香精等用途;黄樟素(图1 化合物2)则天然存在于黄樟油等天然芳香油中,常用在皂用香精中;草蒿脑(图1 化合物3)可由松节油或龙蒿油分馏而得,可用于配制香辛料等调味剂。目前工业上的化学合成方法已非常成熟2。
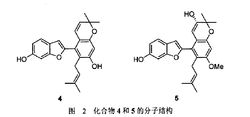
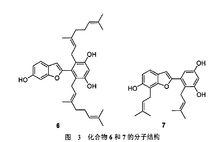
生物学家发现,从桑科植物华桑的茎皮提取出的烯丙基芳烃系列衍生物(图2 化合物4、5和图3 化合物6、7)对人体肺癌、肝癌、胃癌、肠癌和卵巢癌这五种癌细胞系具有较优的治疗作用。后来又发现化合物4和5还具有杀菌消炎和抗氧化作用3。
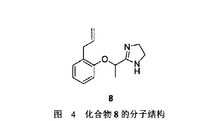
2-(1-(2-烯丙基苯氧基)乙基)-4,5-二氢咪唑(图4 化合物8)是α肾上腺素能受体拮抗剂,在临床上主要用于降低血压、改善微循环、治疗外周血管痉挛性疾病及血栓闭塞性脉管炎4。
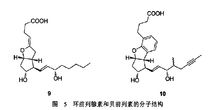
贝前列素(图5 化合物10)作为环前列腺素(图5 化合物9)的衍生物之一,已经在许多国家被用作药物或者尚处于临床试验期间,用以治疗动脉硬化闭塞性脉管炎和肺动脉高压。为了让研究人员对其进行更深入的研究,如何大量制备该化合物是前提条件。2015年,Y.Kobayashi等人利用逆合成分析的方法以2-甲基-6-烯丙基苯酚经多步反应成功合成了贝前列素5。
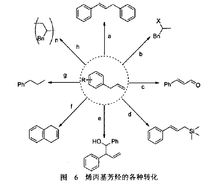
烯丙基的反应活性如此之类的应用数不胜数。除此之外,利用烯烃和α氢的活泼性,烯丙基可转化成多种不同的官能团,总结起来主要有如下几种:a.与碘苯发生Heck反应生成偶联产物;b.与氢卤酸发生亲电加成反应生成卤代烃:c.在不同的氧化条件下生成酮醛类化合物;d.与三乙基氯化硅发生亲电取代反应生成烯丙基硅试剂;e.烯丙基的a氢经活化生成高烯丙醇;f . Grubbs催化剂催化作用下发生复分解反应生成新的烯烃;g.发生还原反应生成烷烃;h.发生聚合反应应用于高分子材料(图6)1。
芳烃烯丙基化方法己报道的芳烃烯丙基化方法主要有:Friedel-Crafts烷基化反应、各类过渡金属催化的交叉偶联反应和芳烃sp2碳-氢键活化等。
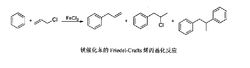
Friedel-Crafts烷基化反应傅克烷基化反应早在十九世纪七十年代就已经被法国化学家查斯·傅里德和美国化学家詹姆斯·克拉夫茨共同发现,在有机合成领域是形成C-C键的重要方法之一。对于这种芳环的亲电取代反应,通常要求苯环上带给电子基团,并以烯丙基醇或者烯丙基卤作为亲电试剂,Lewis酸(如无水AlCl3或FeCl3等)或者Bronsted酸(如HF,H2SO4和H3PO4等)作为催化剂来实现1。
过渡金属催化的交叉偶联烯丙基化反应自上世纪七十年代以来,交叉偶联反应已经受到化学界科研人员们的广泛关注,成为构筑C-C键的重要方法。其主要指卤代烃与带有某主基团中心的有机物在过渡金属的催化作用下生成具有新C-C键的产物R-R’的过程。

通常,交叉偶联反应的反应机理分为三步:首先,卤代烃和金属催化剂发生氧化加成;接着,所生成的中间体与带有某主基团中心的有机物发生金属化转移;最后,经还原消除得到偶联产物并再生金属催化剂。
正是由于交叉偶联反应的高效性使其给学术界如天然产物合成、材料科学、医学、生物学、超分子化学、催化化学和协同化学等带来了不容小觑的影响力。此外,很多方法已经被成功应用到制药业、农用化学品和精细化工等领域1。
过渡金属催化的芳环sp2碳-氢键活化由于sp2杂化C-H键较高的稳定性,故对其进行活化官能化具有重要意义,它不仅给有机合成方法学带来了一场巨大变革,同时也开辟了药物、天然产物及分子材料新的合成路径1。

本词条内容贡献者为:
张静 - 副教授 - 西南大学