科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-09
来源:BioArt
撰文 | 潘雪阳
在生物发育过程中,分化往往被认为是不可逆的过程。生物为应对部分组织的快速更新,往往在发育过程中选择保留一部分低分化的干细胞,如骨髓和皮肤中存在的造血干细胞和表皮干细胞。但对于更新缓慢的大多数其他组织,典型意义上的干细胞往往难觅踪迹。相反,这类组织经常选择利用部分分化程度较高并具有特定生理功能的细胞来完成组织修复或更新工作【1】,而这部分仅在特定条件下具有部分干细胞特性和转分化(Transdifferentiation)能力的细胞在发育生物学研究中往往不能得到足够的重视。
在哺乳动物呼吸道上皮中,负责上皮损伤修复工作的一类神经内分泌(Neuroendocrine,NE)细胞便具有上述细胞的特性。这类细胞呈簇分布在呼吸道上皮中,负责感知呼吸道内的刺激信号并将信号传导至下游的感觉神经元。由于在形态上与周围的纤毛柱状上皮相近并在发育谱系上与上皮细胞同源,这类NE细胞形成的结构被称为神经上皮小体(Neuroepithelial Body,NEB)。NE细胞在生理条件下极少增殖,但在呼吸道损伤过程中则可以迅速通过增殖和转移分化完成对损伤上皮的修复【2,3】。虽然人们对NE细胞的参与上皮修复的功能已经有了初步的了解,但对其中的具体机制则缺乏清晰的认识。
近日,美国斯坦福大学Mark A. Krasnow教授领导的研究小组在Cell杂志上,发表了题为Rare pulmonary neuroendocrine cells are stem cells regulated by Rb, p53, and Notch的文章,对NE细胞完成呼吸道上皮修复的机制进行了深入研究。

在研究中,作者利用神经生物学研究中常用的彩虹荧光(Rainbow Fluorescence)标记方法对NE细胞进行了标记,并观察了上皮损伤后NE细胞的反应。利用胸苷类似物EdU,作者识别了损伤后出现增殖的NE细胞,并发现在每个NEB结构中只有少部分(约30%)细胞发生了增殖,且在每次损伤中出现增殖的为同一NE细胞亚群。这证明了在NEB中存在一部分特定的、具有干细胞功能的NE(NEStem)细胞参与损伤修复过程。除细胞增殖外,作者同时发现在上皮损伤后一部分(约15%)NE细胞会产生细胞迁移和扩散,向脱离NEB的方向产生“滑行”(Slithering)。NE细胞的上述增殖和扩散过程发生在损伤后的一周内,在此期间增殖和扩散的细胞都保持着NE细胞特性,证明损伤后短时间内NEStem细胞仅完成了自我更新(Self-renewal)而并未完成去分化。在此后的两周内,NEStem细胞会在NEB周围形成大面积的再生上皮,完成损伤修复。有趣的是,每个NEB周围的再生上皮均来自同一个NEStem细胞的单克隆增殖,而这一阶段新生的上皮细胞也不再表达NE细胞标志物Calcitonin Gene-Related Peptide(CGRP),显示NEStem细胞此时已经完成了转移分化的过程(图1)。
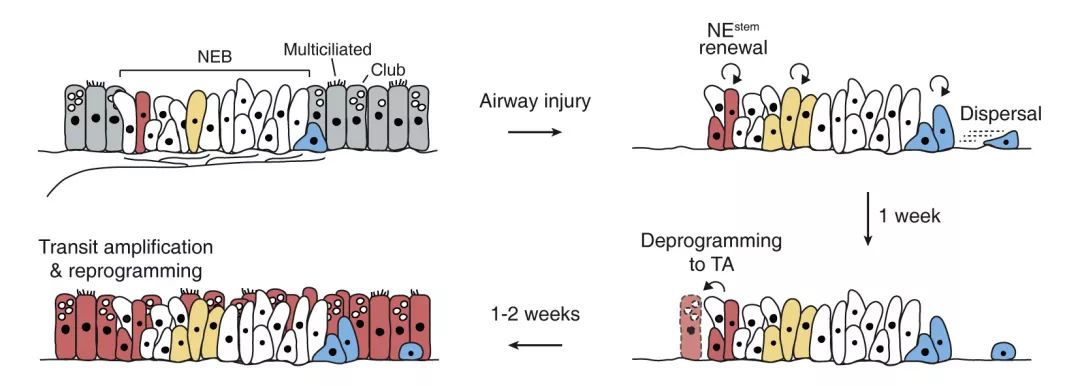
图1 NE细胞介导的呼吸道上皮损伤修复过程
为研究调控损伤修复过程的分子机制,作者对NE细胞和周围上皮细胞进行了单细胞RNA测序,并依据测序结果分析了调控修复过程的信号通路。利用基于T-distributed Stochastic Neighbor Embedding (t-SNE)的RaceID2算法【4】,作者对流式分离得到的225个NE或上皮细胞的表达谱进行了聚类分析(Clustering),并发现了五种不同类型的细胞。在NE来源的100个细胞中,95个被归类为NE细胞类型,而另外5个则分属于其他四种类型,证明在损伤修复过程中一部分NE细胞完成了转移分化。利用主成分分析(Principal Components Analysis,PCA)的方法,作者发现了包括上述5个细胞在内的8个NE来源的细胞具有“过渡”细胞(”Transitional” Cell)的特性,即低表达NE标记基因Resp18并高表达呼吸道上皮标记基因Cbr2。通过进一步分析,作者发现在225个细胞中Notch信号通路转录因子Hes1的表达与Cbr2的表达高度相关,而在对更多NE来源细胞的分析中也发现了Hes1阳性的细胞亚群。由此,作者猜测Notch通路在NEStem细胞修复上皮损伤过程中起到了关键作用。
接下来作者证明了Notch通路在损伤修复过程中对NEStem细胞去分化的作用。在生理条件下,NEB中无法检测到Notch通路激活的细胞,而在损伤刺激后Hes1阳性细胞则逐渐出现。Hes1阳性细胞通常出现在NEB的外周部位,预示着激活NEStem细胞修复功能的信号可能来源于NEB周围的损伤上皮组织。抑制NE细胞的Notch通路会严重影响损伤修复的进程,而激活Notch通路则可以在没有损伤的情况下诱导NE细胞去分化。这一结果证明Notch通路对于NEStem细胞的去分化过程至关重要,但作者同时发现,Notch通路的激活并不能诱导去分化的NEStem细胞完成增殖和再分化为上皮细胞。
在关注Notch通路的过程中,作者注意到Notch通路的激活发生在NEStem细胞自我更新过程之后,而且调节Notch通路也不能影响损伤修复初始阶段NEStem细胞的自我更新和扩散过程。其他研究表明,NE细胞在Rb/p53功能缺失的条件下可以恢复增殖功能并发展为小细胞肺癌(Small Cell Lung Cancer, SCLC)【2,5】,由此作者猜测Rb/p53信号通路可能调控了损伤初期NEStem细胞的增殖和自我更新过程。在接下来的研究中,作者发现敲除Rb和p53基因会导致部分NE细胞在非损伤条件下出现增殖,而Rb/p53缺失诱导的增殖NE细胞与损伤过程中激活的NEStem细胞高度重合。二者不同之处在于, NEStem细胞在完成有限的增殖后会恢复静默状态,而Rb/p53缺失诱导的增殖过程则不会恢复。此外,Rb/p53缺失的NEB中会有更多的NE细胞出现增殖。而在后续的上皮修复过程中,Rb/p53缺失的NE细胞修复的上皮组织的范围也更大。有趣的是,虽然Rb/p53缺失会诱导NE细胞的过度增殖和上皮的过度修复,但没有损伤的条件下Rb/p53缺失的NE细胞不会产生上皮修复过程中的增殖和分化。
通过对上述信号通路的研究,作者进一步描绘了呼吸道上皮损伤后NEStem细胞作为干细胞参与上皮修复的分子机制。在上皮损伤后,NEStem细胞将接收多个不同的信号完成损伤修复过程。首先,受到损伤细胞会产生信号抑制NEStem细胞中Rb/p53的活性,使NEStem细胞完成增殖和自我更新。与此同时,另一信号会诱导NEStem细胞产生迁移和扩散。在此之后, NEStem细胞的Notch通路将被激活,从而诱导NEStem细胞完成去分化过程,并在后续信号的引导下完成过渡放大(Transit Amplification)和再分化过程并修复损伤的上皮细胞(图2)。
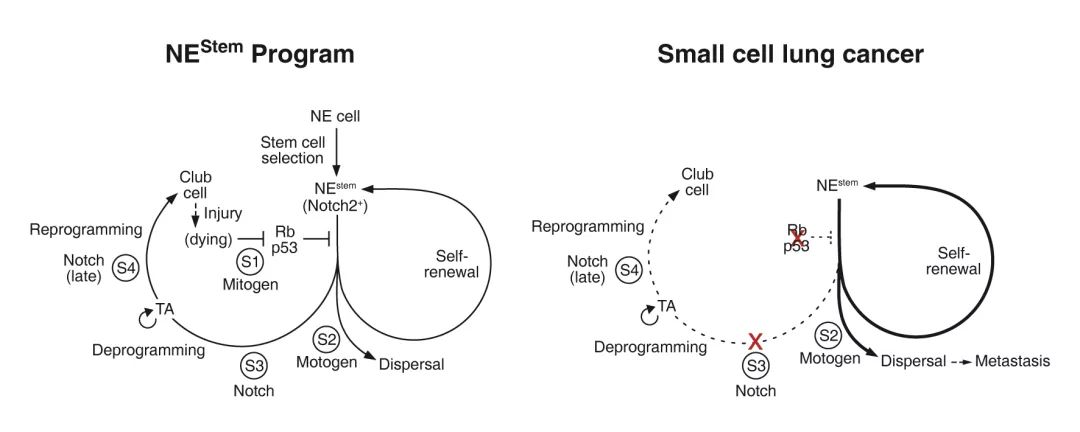
图2 NEStem细胞在修复上皮损伤与癌变过程中的信号通路
综上,作者通过本文的研究从形态上具体描述了NE细胞修复呼吸道上皮损伤的过程,并阐释了其中的分子机制。这一发现加深了人们对具有干细胞特性的高分化细胞实现干细胞功能的机制的理解。另一方面,本文也验证了Rb/p53这一抑癌通路对NE细胞增殖的影响,从而支持了人们对NE细胞作为小细胞肺癌组织来源的认识。由此,本文也提示了上皮损伤在小细胞肺癌进展过程中的重要诱导作用,而本文阐述的NE细胞修复上皮损伤的机制也对研究小细胞肺癌早期发展的机制具有借鉴意义。
原文链接:
https://doi.org/10.1016/j.cell.2019.09.010
参考文献
1. Clevers, H., and Watt, F.M. (2018). Defining Adult Stem Cells by Function, not by Phenotype. Annu Rev Biochem 87, 1015-1027.
2. Song, H., Yao, E., Lin, C., Gacayan, R., Chen, M.H., and Chuang, P.T. (2012). Functional characterization of pulmonary neuroendocrine cells in lung development, injury, and tumorigenesis. Proc Natl Acad Sci U S A 109, 17531-17536.
3. Kuo, C.S., and Krasnow, M.A. (2015). Formation of a Neurosensory Organ by Epithelial Cell Slithering. Cell 163, 394-405.
4. Grun, D., Muraro, M.J., Boisset, J.C., Wiebrands, K., Lyubimova, A., Dharmadhikari, G., van den Born, M., van Es, J., Jansen, E., Clevers, H., et al. (2016). De Novo Prediction of Stem Cell Identity using Single-Cell Transcriptome Data. Cell Stem Cell 19, 266-277.
5. Sutherland, K.D., Proost, N., Brouns, I., Adriaensen, D., Song, J.Y., and Berns, A. (2011). Cell of origin of small cell lung cancer: inactivation of Trp53 and Rb1 in distinct cell types of adult mouse lung. Cancer Cell 19, 754-764.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652477546&idx=4&sn=fcfa43b0aa1944c28292aed10224f180&chksm=84e20bdeb39582c8a2e1a5dde7ecf63262bb1c1a5c5724704e1201f1e6833958f6d01c95d751&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
发现新的神经内分泌性前列腺癌的生物标记物和治疗靶点
Cell Chem Biol | 化学生物学助力开发新型抗胶质母细胞瘤抑制剂

Cell:胃肠胰神经内分泌的肿瘤类器官生物库

Nature :葡萄糖感知神经元调节糖稳态的神经内分泌机制

昆明动物所等在百岁老人健康长寿保护机制研究中取得进展----中国科学院

你以为鸟类的羽毛都是随便长的?

科学家发现神经内分泌激素SN在神经血管发育中的新功能

飞秒激光刺激:改变细胞命运的新“钥匙”

GUT:北京协和医院发表胰腺神经内分泌肿瘤分子分型模型

大医同行 |【活动预告】前列腺神经内分泌肿瘤的思考(第五场)