科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-17
烯醇化物等价体对α,β-不饱和羰基类化合物的加成反应是构建C-C键的常用方法之一,相应的不对称催化反应也在过去的几十年中得到广泛的研究。α,β-不饱和醛、酮可通过亚铵离子、Brønsted酸及Lewis酸等参与的不对称催化方法实现Michael加成。
简介α,β-不饱和酯参与Michael加成反应的研究至今已有一百多年的历史,然而其不对称催化过程仍然面临着挑战。Herbert Mayr等人对一系列的Michael加成受体进行了系统的定量研究,数据表明,相比于其他Michael加成受体,α,β-不饱和酯的亲电活性较低。1

不对称Mukaiyama-Michael偶联反应环状N-磺酰基亚胺酯和烯醇硅醚的不对称Mukaiyama-Michael偶联反应。
底物的合成(1)环状N-磺酰基亚胺酯类化合物的制备方法
由不同取代的苯磺酰氯和叔丁胺反应制备N-叔丁基苯磺酰胺,在丁基锂的作用下使邻位发生锂金属化,与草酸酯发生加成反应,得到缩醛胺中间产物,最后在甲酸条件下脱叔丁醇得到相应的环状N-磺酰基亚胺醋。
(2)烯醇硅醚的制备方法
不同取代的苯乙酮或苯丙酮在双三甲基硅基胺基锂的作用下,脱去a-质子,三甲基氯硅烷淬灭反应得到芳基取代的烯醇硅醚。此方法也适用于制备环己酮或1-正庚酮衍生的烯醇硅醚。
(3)反应过程
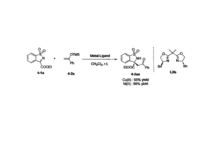
本部分工作主要研究了芳基酮衍生的烯醇硅醚和环状N-磺酰基亚胺酯的不对称Mukaiyama-Mannich加成反应,使用高氯酸镍一双嚷哇琳手性络合物作为催化剂,以优异的收率(93-98%的收率)和对映选择性(84-99%ee)得到系列不同取代的含手性季碳中心的苯并磺内酰胺类化合物,
该反应具有以下几个优点:反应条件温和((0℃或室温条件下),催化剂廉价易得且用量小(大部分情况下应用2 mol%),底物普适性高(电子效应和位置效应对催化结果影响不明显),可以进一步拓展此催化体系的应用范围至双烯基烯醇硅醚或者有空间位阻的烯醇硅醚,如a-取代苯乙酮衍生的烯醇硅醚和N-磺酰基亚胺酯的Mukaiyama-Mannich加成反应,再如,双烯基硅醚参与的vinylogous Mukaiyama-Mannich加成反应,均取得优异的收率和优良的立体选择性。
此外,Mannich产物经氧化胺化反应可衍生为对映选择性保持的苯并磺内酞胺并叮咤环类化合物;还可以经分子内Ulltnann反应构建苯并磺酰胺并二氢喹诺酮的全新骨架。
该研究工作是首例利用手性路易斯酸催化N-磺酰基亚胺酯的Mukaiyama-Mannich加成的策略,实现高光学活性的含有手性季碳中心的3-位芳基酮取代的苯并磺内酰胺类化合物的制备方法。该合成策略为活性药物分子的开发奠定了方法学基础。1
本词条内容贡献者为:
张静 - 副教授 - 西南大学