科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-11
来源:iNature
上海交通大学医学院附属瑞金医院、上海血液学研究所、医学基因组学国家重点实验室蒙国宇教授团队于2019年10月在The FASEB Journal 上发表题目为”How BamA recruits OMP substrates viapoly-POTRAs domain“的研究论文,该研究发现BamA(在细菌和人中高度保守)如何通过POTRA结构域募集OMP(外膜蛋白)的分子机制,确定了a2-b2界面是OMP与BamA的作用位点,在BAM领域首次提出了“fishing”的外膜蛋白合成模型。
上海交通大学医学院附属瑞金医院、上海血液学研究所、医学基因组学国家重点实验室蒙国宇教授团队曾于2018年3月在Nature Communications上发表题目为"Ring tetramerization is required for nuclear body biogenesis and PML sumoylation"的研究论文,该研究从分子水平上揭示了PML核体组装机制及PML自身SUMO化修饰的结构基础,并发现PML-RING的四聚化对急性早幼粒细胞白血病(APL)的发病及其靶向治疗都有很重要的意义(点击阅读);
紧接着在2019年8月份,蒙国宇教授团队再次在Nature Communications上发表题目为"B1 oligomerization regulates PML nuclear body biogenesis and leukemogenesis"的最新研究成果。这些系列研究发现在PML-RING结构域介导的四聚的基础上,PML-B1box结构域能够介导一种前所未有的寡聚化模式,进而形成PML核体。同时,研究者通过转基因小鼠和单细胞技术进一步证实了蛋白寡聚在白血病发病的重要意义,为后续的靶向治疗提供新的思路(点击阅读)。
细菌感染是一个世界范围内主要的卫生问题,临床上使用的抗生素主要是通过阻断细菌的核酸合成、核糖体的蛋白质合成、叶酸合成和细胞壁的合成来抑制病原菌的生长,近几十年间拯救了无数人的性命。但是近年来“超级细菌”的出现使得这一局面发生了变化,据世界卫生组织披露,现在每年全球有大约70万人死于“超级细菌”,大部分发生在发展中国家,23万新生儿因此而夭折,而等到2050年死亡人数可能超过1000万。而大多数革兰氏阴性细菌表面外膜毒性因子是通过β-barrel组装机器(β-barrelassembly machinery,BAM)来进行生物合成的,这样就使得BAM成为抗细菌感染的新靶标。但是到目前为止,还不清楚BAM machinery是如何招募其OMP底物,这是该领域一直悬而未解的难题。
上海交通大学蒙国宇团队一直致力于血液系统疾病基础与临床应用的研究。在此领域,该团队曾先后在国际知名期刊(Ma et al, 2019; Zeng et al,2017; Lei et al, 2015; Meng et al, EMBO J, 2011; Cai et al, 2010)发表研究成果。在该项研究中,研究人员聚焦到了病原菌毒素分子的合成源头——BAM复合物。BAM 复合物主要由5种蛋白组成,而该研究中的主要对象BamA就是其重要的核心组分,并被证实其在外膜蛋白组装过程中起到了极其重要的作用。BamA由3个结构域构成,氮端的信号肽(signal peptide,SP),位于周质间的多个多肽转移相关(polypeptide-transport-associated,POTRA)结构域和碳端的跨膜b-barrel。
在该研究中,研究人员通过结构生物学手段获得了流感嗜血杆菌BamA中POTRA结构域的晶体结构,通过对基于结构的细胞生化实验分析,大胆地提出POTRA的flexibility特性介导外膜蛋白运输组装的假说模型(图1)。研究人员利用生物物理学手段(SAXS,CD等)和体内外功能实验,多角度印证该模型。POTRA的flexibility在多种已获得的结构中都可以被观察到,结合对各POTRA-POTRA间linkage以及a2-b2界面进行突变研究,研究人员发现一种“钓鱼”新机制:BamA利用其POTRA的flexibility特性募集外膜蛋白底物,并将其运送进入外膜中的β-barrel,而在此期间其他BAM复合物的组分(lipoproteins)起到调节作用。
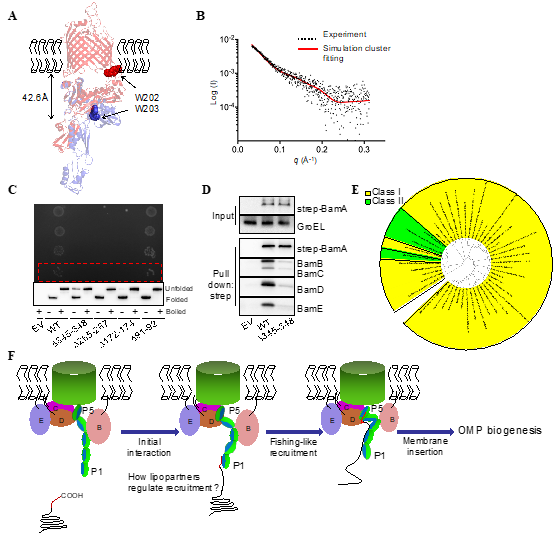
图1:POTRA介导的病原菌外膜蛋白合成的“钓鱼”新模型。A.流感嗜血杆菌BamA中W202/W203在不同构象中的位置。B.SAXS实验测定POTRA结构域状态。C.POTRA的灵活性对BamA的功能和细菌生长是必要的。D.体内pull-down实验。E.BamA家族蛋白的进化发育分析。F.在该领域首次提出了BAM如何利用poly-POTRA募集外膜蛋白底物的“钓鱼”模型,是该领域的一个突破性的进展。
临床和应用前景:在当前“超级细菌”出现的严峻情况下,可以预期到传统意义上的抗生素在未来将难以治疗临床上出现的细菌感染,这就使得普通的外科手术都无法进行。人类即将面临艰难的时刻,而新型抗菌药物的研发就迫在眉睫。BAM作为细菌侵染毒素分子的合成源头,将会是极佳的新靶标的候选者,而该研究团队对BAM分子机制的研究则为这种可能性提供了基础,从而为人类对抗“超级细菌”的战斗提供了强有力的杀伤性武器。蒙国宇团队的博士生马晓丹、硕士生王倩倩和博士李玉文为文章的并列第一作者。蒙国宇教授为论文的通讯作者。该研究获得国家自然科学基金、上海市科委教委基金等项目、上海同步辐射光源和国家蛋白质中心的支持!
参考消息:
https://www.fasebj.org/doi/pdf/10.1096/fj.201900681RR
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247505473&idx=8&sn=7536609fe4b8d8232f6b4d14f11ea68e&chksm=fce6a59ecb912c884f9943651dbd47a6e583a712290adfc7a6b65f1db2814b413a83821f0b96&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn