科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-12-11
来源:中国生物技术网
自2018年首次报道线粒体和溶酶体存在直接接触(mitochondriaand lysosome contact, MLC)以来,对MLC的判定只能通过超分辨率显微镜和电子显微镜测量细胞器间的物理距离来确定。尚无能直接显示MLC的精确位置的生化方法。为了解决这一难题,南京大学郭子建院士/何卫江教授课题组,利用线粒体和溶酶体内活性硫环境和性能的差异,开发了一种细胞渗透性、生物相容性、黏度响应性的小分子荧光探针Coupa,用于同时成像线粒体-溶酶体以研究活细胞中线粒体和溶酶体的相互作用。相关工作以题为“Adual-labeling probe to track functional mitochondria-lysosome interactions inlive cells”已于12月8日在《Nature Communications》上发表。

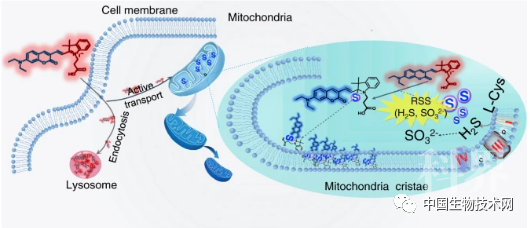
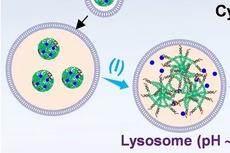
双标记成像原理。图片来源于 Nature Communications
研究人员发现,Coupa在溶酶体上时会发射红光(Coupa-lyso),在线粒体中可与活性硫作用发生结构改变而发射蓝光(Coupa-mito)。利用这一特点,该探针可用于同时观测线粒体和溶酶体,显现两者间亚细胞水平相互作用的动态跟踪。更重要的是,Coupa还能够在亚细胞器水平精确定位黏度变化,从而首次发现线粒体-溶酶体接触部位的局部黏度增加。
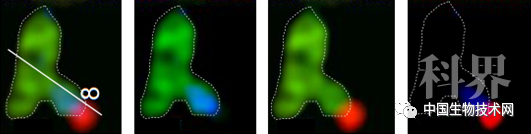
Coupa双色标记识别MLC接触位点(绿色:商用线粒体MTG探针;蓝色:Coupa-mito标记的线粒体部分;红色:Coupa-lyso标记的溶酶体部分)。图片来源于Nature Communications
这一工作不仅提供了用于定位和动态跟踪活细胞中功能性线粒体-溶酶体的相互作用的探针,也提供了一种新的设计策略,利用线粒体中独特的内部环境来转换探针的结构,使其发出不同的颜色,从而实现多色标记。这一设计原则也可推广用于设计其它多细胞器多色成像探针上。论文的第一作者为陈启鑫博士和方红宝博士,南京大学作为论文的第一完成单位,张凯教授,何卫江教授,郭子建院士和刁佳杰教授为本文的通讯作者。
课题组简介
郭子建,中国科学院院士,教育部长江学者奖励计划“特聘教授”,国家杰出青年科学基金获得者,曾获意大利化学会Sacconi奖章、教育部自然科学一等奖等。主要研究领域为化学生物学,从事金属及其配合物的化学生物学研究,设计构筑了系列金属离子荧光探针,建立和发展了相关的体内外荧光成像方法,观察到离子的迁移和富集现象;探索了金属抗肿瘤药物反应性能及活性差异,构建了新型铂类药物靶向传输体系;发展了系列基于铜配合物的人工核酸酶,研究了它们的构效关系及金属中心间的协同效应、DNA断裂能力及抗肿瘤活性间的关联等。
何卫江,南京大学教授、博士生导师,2001年南京大学获博士学位并获南京大学和江苏省优秀博士论文奖。2002年在德国马普胶体与界面研究所进行博士后研究。2003年至今在南京大学配位化学国家重点实验室工作。主要研究方向为生物相关无机小分子物种的荧光探针设计、细胞/活体造影及其在小分子生物无机化学研究中的应用,光活化金属配合物与生物分子的相互作用,无机金属药物及重金属探针的设计、成像及其在药理、毒理研究中的应用,已在Nat. Commun.; J. Am. Chem. Soc.; Angew. Chem.Int. Ed.; Chem. Soc.Rev.等知名学术刊物上发表论文近百篇。
来源:biotech-china 中国生物技术网
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5ODU5NDgyMg==&mid=2653958670&idx=3&sn=7494ca9db9e3f775d13761c8b52f6876
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

厦门大学林圣彩团队迎来开门红

Science |揭示冠状病毒复制特殊“细胞器”
发现植物“伏地魔”细胞器演化的秘密
睡莲属植物细胞器RNA转录后加工研究取得进展



新型细胞器改写教科书,迁移体你了解多少?
通过DNA动态组装在细胞内构建类细胞器结构

新概念细胞器,支持各种细胞膜表面的蛋白质翻译

中文解读 | 脑出血后铁毒性、脂质过氧化和铁死亡

北方是家鸡的驯化中心?线粒体DNA分析不支持
睡莲属植物细胞器RNA转录后加工研究取得进展