科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-12-15
来源:BioArt
区别自我和非我是维持免疫稳态的基础。病毒核酸是宿主抗病毒免疫的主要驱动因素,那如何确保自我来源的DNA和RNA不被错误识别为非我是具有挑战的问题。I型干扰素病的分子定义是与I型干扰素信号持续增强相关的自发炎症性疾病,这表明机体对于自我和非我的鉴别是非常重要的。
近期的研究显示,微核内受损的DNA是具有免疫刺激作用的,这表明细胞核本身是可以作为能够诱导先天免疫反应的核酸来源。虽然核膜可以对细胞质内核酸传感器起屏蔽作用,但当有丝分裂期间核膜破裂时,双链DNA感受器cGAS可与染色质结合【1】。cGAS在核膜破裂后进入细胞核,可定位于细胞核内。这些观察结果提出了一个问题,核DNA的免疫原性是如何被调节的,从而在抗病毒反应中保持cGAS对DNA的反应敏感性的同时,限制自身炎症的风险?
近日,来自英国爱丁堡大学的Yanick J. Crow在Nature Genetics杂志发表文章cGAS-mediated induction of type I interferon due to inborn errors of histone pre-mRNA processing,对2名遗传特征不明的I型干扰素病Aicardi-Goutières综合征患者进行全外显子测序,鉴定出LSM11和RNU7-1具有双等位基因突变,两者编码复制依赖性组蛋白pre-mRNA处理复合物的组分。该突变与典型组蛋白转录的错误处理、连接体组蛋白化学计量的紊乱有关。此外,病人来源的成纤维细胞中,突变导致核定位的cGAS分布发生改变,通过STING途径增强干扰素信号。体外构建无连接组蛋白的染色质能更有效地刺激cGAMP的产生,激活干扰素信号。即作为染色质重要的组分——核组蛋白,对于抑制自我DNA的免疫原性具有重要作用。

研究人员首先选取了2位受到AGS影响的兄弟姐妹,进行全外显子测序,鉴定出LSM11中具有一个纯和的c.631G>A的转换,导致LSM11的蛋白发生突变,且该突变没有被记录。LSM11形成U7 snRNP复合物,参与复制依赖性组蛋白(RDH) pre-mRNAs的处理过程。虽然在其他病人中没有检测到LSM11的病理性突变,但在11个独立家系的16例患者中检测到RNU7-1(编码snRNA U7)具有双等位基因变异,而663名对照中没有检出RNU7-1的双等位基因突变。
RDH基因编码四种核心组蛋白(H2A、H2B、H3和H4)和连接组蛋白家族H1(linker histone),具有独特的特征,其不具有内含子,编码已知的唯一一个在3‘端没有poly(A)尾的真核mRNA,而是以一个保守的茎环终止。茎环结构的形成是由pre-mRNA在茎环和组蛋白下游元件HDE(富含嘌呤的序列)进行核内裂解形成。而茎环结合蛋白和U7-snRNP分别结合在茎环和HDE部位【2-3】,从而实现RDH pre-mRNAs的处理过程。而组蛋白pre-mRNA处理过程如果失败,由于U7依赖性切割位点下游具有隐形的多聚腺苷酸化信号,可能导致异常的含有poly(A)的mRNA亚型出现。检测病人来源的成纤维细胞,发现LSM11或RNU7-1突变的病人细胞具有富集的RDH mRNA的错误处理形式,敲除LSM11能观察到类似的结果。而且,LSM11或RNU7-1突变的病人细胞中连接子和核心组蛋白的mRNA表达与对照组具有显著差异。对病人和对照组来源成纤维细胞中poly(A)+和poly(A)-组分进行RNA-seq,观察到病人来源细胞中多聚腺苷酸化的RDH mRNA转录本整体增加,而成熟的非多聚腺苷酸化的RDH基因转录本减少;并且连接子和核心组蛋白同样出现多聚腺苷酸化的转录本增加,而非多聚腺苷酸化的转录本减少。即LSM11或RNU7-1病理性功能缺失突变影响RDH pre-mRNA 处理过程。
AGS是I型干扰素病,具有增强的I型干扰素产生。从16名病人的血液中检测到上调的干扰素刺激基因(ISGs)的表达,病人来源的成纤维细胞中同样检测到ISGs基因和蛋白的表达升高。在THP1细胞或病人来源成纤维细胞中,LSM11的表达降低导致错误处理的RDH mRNA增加,ISGs和IFN-β诱导增加;进一步缺失cGAS或STING降低LSM11敲低诱导的IFN增加,而缺失MAVS(RNA感知器)不影响。此外,病人来源成纤维细胞中cGAMP增加。这表明组蛋白pre-mRNA处理过程的失调中,是DNA,而不是RNA,导致了IFN信号的增加。于是,研究人员提出了一个假设:细胞内组蛋白水平和染色质结构的扰动会导致cGAS的诱导产生。首先分离病人和对照的成纤维细胞的细胞核部分,检测发现病人中连接子组蛋白的整体水平减少,而核心组蛋白的水平没有影响。在THP1中敲低H1.4(连接子组蛋白)诱导较高的ISGs表达,即连接子组蛋白的降低可能激活cGAS-STING依赖的炎症信号。
cGAS核定位的出现意味着基因组DNA在某种程度上是免疫惰性的,但体外的研究显示cGAS可以结合染色质并被激活。核小体对cGAS的亲和力比裸露的DNA更高,其对DNA依赖的cGAS激活具有相对的抑制作用。那么,研究人员推测细胞核DNA的组蛋白组成可能会影响cGAS的结合和/或活化。检测发现,病人来源的成纤维细胞中,cGAS的细胞核分布发生改变,畸形细胞核的频率增加。体外组装染色质发现,没有连接子组蛋白的染色质导致重组的cGAS产生cGAMP,即cGAS-STING通路是激活的。
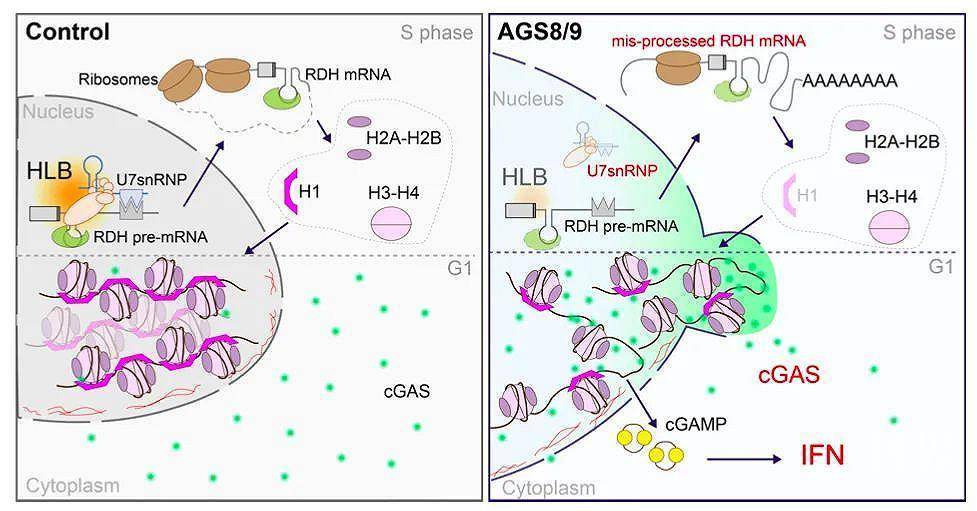
总的来说,研究揭示出复制依赖性组蛋白pre-mRNA处理复合物组分LSM11和RNU7-1的突变或可解释AGS相关表型,即LSM11和RNU7-1突变导致组蛋白mRNA转录本处理过程发生失调,连接子组蛋白水平下降,通过cGAS-STING通路诱导IFN表达。同时证明细胞核组蛋白活在维持自身DNA低免疫原性上具有重要作用。
参考文献
1. Zierhut, C. et al. The cytoplasmic DNA sensor cGAS promotes mitotic cell death. Cell 178, 302–315.e23 (2019).
2. Martin, F., Schaller, A., Eglite, S., Schümperli, D. & Müller, B. The gene for histone RNA hairpin binding protein is located on human chromosome 4 and encodes a novel type of RNA binding protein. EMBO J. 16, 769–778 (1997).
3. Sabath, I. et al. 3′-End processing of histone pre-mRNAs in Drosophila: U7 snRNP is associated with FLASH and polyadenylation factors. RNA 19, 1726–1744 (2013).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652514403&idx=5&sn=b4cde7bb2347e3bc7e70cf87e38af790
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

为什么要做新冠病毒核酸检测?

注意!核酸阴性不能排除新冠病毒感染!

新冠病毒又变异!核酸检测或无法检出

关注!新冠病毒核酸检测降价了
新冠病毒又变异!核酸检测或无法检出
结构匹配度调控策略实现商用AGS材料性能大幅提升
为什么要做新冠病毒核酸检测
【关注】为什么要做新冠病毒核酸检测?

Angew. Chem.:结构匹配度调控策略实现商用AGS材料性能大幅提升
新冠病毒又变异!核酸检测或无法检出