科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-01
来源:化学加
导读
来源:tryingchem 化学加
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwODA5MjQ3Ng==&mid=2653106849&idx=3&sn=e60deb39c7ca2493105d45bcc21ab8c9
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

【科技前沿】基于人工金属酶的原位动态观测肿瘤治疗效果的分析方法
光电发射探讨摩擦起电中的电子转移过程

磁性电极无损转移制备高性能自旋电子器件获进展

基于环二核苷酸组装高效人工RNA金属酶的手性催化
电子转移

打造人工金属酶用于肿瘤治疗

固-液起电中的电子转移以及双电层形成新理论
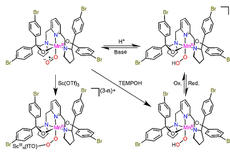
大连化物所等在金属酶及模拟配合物催化分子氧活化的反应机理研究中取得进展

基于电荷转移及电子转移构筑刺激响应材料

中科院等科学家合作在生物催化交叉偶联-光驱动卤代芳烃羟化脱卤酶研究中获进展