科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-07
印度药品监管机构1月3日批准了两款新冠疫苗,总理莫迪称这一决定是对抗新冠疫情的决定性转折点,证明了印度科学界可以自力更生。
但一些科学家和病患对这一举措提出了尖锐批评,特别是在印度相关部门为Bharat Biotech公司开发的疫苗Covaxin“开绿灯”后。因为该疫苗没有得到III期临床试验结果以确定其疗效和安全性。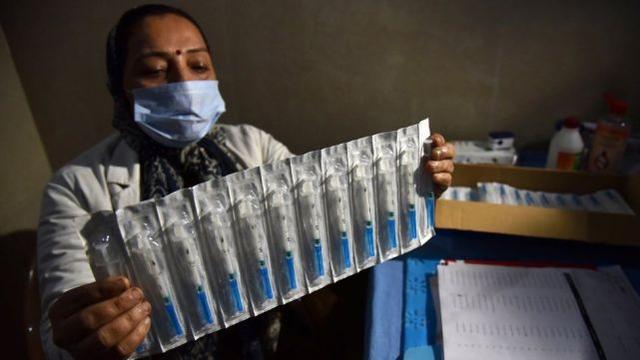 据《科学》报道,在近日举行的新闻发布会上,印度药品监督局局长V.G.Somani说,尽管相关机构正在招募参与者对Covaxin的疗效进行研究,但他还是批准该疫苗作为一种预防措施,以遏制在英国首次发现的传染性很强的变异新冠病毒的传播。
据《科学》报道,在近日举行的新闻发布会上,印度药品监督局局长V.G.Somani说,尽管相关机构正在招募参与者对Covaxin的疗效进行研究,但他还是批准该疫苗作为一种预防措施,以遏制在英国首次发现的传染性很强的变异新冠病毒的传播。
Somani说,该疫苗和另一种疫苗是英国牛津大学和阿斯利康公司开发的印度版疫苗,获准在紧急情况下有限制的使用,而疫苗制造商则在继续进行相关临床试验。
印度国家免疫学研究所的免疫学家Vineeta Bal认为,在没有III期临床试验数据的情况下批准疫苗是“不合理的”。对此,维洛尔基督教医学院微生物学家Gagandeep Kang表示赞同,并表示这一决定也忽视了由Somani领导的印度中央药物标准控制组织(CDSCO)的指导方针。该组织规定疫苗生产者必须在第三阶段试验中证明疫苗达到50%的最低有效性才能获得批准。
对此,相关人员表示Covaxin将作为“备用”疫苗,在印度因变异新冠病毒导致病例激增时才会使用,并称在III期临床试验数据出台之前紧急批准疫苗并不罕见。
但Kang指出,该疫苗的一种增强免疫反应的佐剂从未在已批准的疫苗中使用过。“我不认为有人能保证,当成千上万人接种该疫苗后,不会出现任何不良影响。”最重要的是,科学家还不能根据第二阶段试验中测得的免疫反应准确预测疫苗的疗效。
科学家担心CDSCO的这一匆忙决定,可能会损害公众的信任。还有一些人认为,印度的情况还没有糟糕到需要疫苗跳过III期临床试验的程度。
作者:徐锐
来源:中国科学报

新疫苗可提高免疫细胞对抗流感能力
中国标准化协会关于《临床实验室自动化系统技术要求》等4项标协标准立项的公示
Nature关注:为了治疗新冠肺炎,中国已开展双黄连,氯喹等80多项临床实验

发布2019新型冠状病毒肺炎临床实验室检测的生物安全防护指南
《2019新型冠状病毒肺炎临床实验室检测的生物安全防护指南(试行第一版)》

中美两国的疫苗有区别吗?临床实验意味着什么?疫苗何时能研发上市?

华为获印度批准,可参与5G网络试验

巴西科学家测试抗可卡因疫苗
全球首发国产新冠特效药,获批开展临床实验!
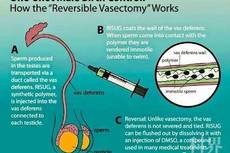
世界首款男性避孕针通过临床实验:一针管13年 成功率97.3%