科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-30
来源:BioArt植物
植物免疫活动中,病程相关蛋白介导的免疫过程(PTI)和效应子诱导植物免疫过程(ETI)分别代表了病原菌和寄主植物互作过程的两个层面,两者之间既有区别又存在紧密的联系【1】。病原菌分泌的病程相关分子模式(PAMPs)通过特异性识别宿主细胞表面的模式识别受体(PRRs)诱导免疫。对于植物病原真菌,几丁质寡聚糖是典型的PAMP【2,3】。几丁质由一系列1,4连接的N-乙酰氨基葡萄糖组成,该组份广泛分布在真菌细胞壁、节肢动物外骨骼及线虫中【4,5】。在植物病原真菌侵染宿主过程中,宿主产生的水解酶如几丁质酶可以将真菌细胞壁降解产生几丁质寡聚物,这些几丁质低聚物进而激活宿主免疫反应。识别几丁质低聚物的分子位于细胞表面,已知有CEBiP和CERK1等,这些PPRs识别几丁质低聚物后,会诱导一系列免疫反应,包括ROS积累及胼胝质沉积等【6,7】。狡猾的植物病原真菌拥有特殊的几丁质酶去乙酰酶抑制活性蛋白,这类蛋白对真菌细胞膜进行修饰,从而减弱了被宿主几丁质酶降解的活性,达到病菌侵染的目的【8】。类似功能的效应子在稻瘟病菌和球腔菌中已有报道,然而白粉病菌中类似功能的蛋白尚未经过系统的研究。
近日,西班牙国立马拉加大学的研究人员在The Plant Cell发表了一篇题为Effectors With Chintinase Activity (EWCAs), a family of conserved, secreted fungal chitinases that suppress chitin-triggered immunity的研究论文。该研究利用基因表达分析、RNAi沉默分析、蛋白质建模和蛋白配体结合预测、酶活性检测及蛋白定位等方法深入探究了瓜类白粉病菌内EWCA(Effectors With Chitinase Activity)类效应子抑制植物免疫的机制。


该研究首先通过序列相似性分析和侵染过程中基因表达量差异检测,鉴定到白粉病菌中一类未知功能的蛋白PECs;对候选PEC基因进行沉默后,利用qPCR评估真菌生物量,发现突变体菌落变小吸器更少,进一步检测胼胝质沉积和过氧化氢的积累情况,发现突变体菌株跟野生型相比显著诱导了宿主的免疫。
为了探究这些蛋白的功能,该研究利用I-TASSER对PEC蛋白进行模型预测,发现这些蛋白拥有一个保守的未知功能区域(DUF),进一步生物信息学分析潜在的受体绑定位点,发现PEC蛋白类似糖苷水解酶家族,并且可能扮演几丁质酶的功能。为了研究PEC蛋白的几丁质酶活性,对四个PEC蛋白体外表达检测其与纤维素、胶体几丁质和木聚糖的结合能力,经过不同组合的生化实验证实了该蛋白家族的几丁质酶活性,并命名为EWCAs (Effector With Chitinase Activity)。
研究人员通过同时突变PECs和几丁质受体蛋白CERK1弥补了PECs突变体毒力下降的表型,确定了EWCAs参与几丁质介导的免疫,通过融合GFP和不同EWCAs功能表达,检测到这些蛋白定位在真菌吸器侵染部位植物的乳突中。胼胝质沉积实验证明植物乳突定位与效应子功能有关,共聚焦扫描分析EWCA蛋白总是定位在小吸器中。最后研究人员分析了EWCA蛋白在真菌中的保守性,发现该类蛋白广泛分布在昆虫、线虫、动物等的病原真菌中,并且都与DUF结构域相关,同时发现不同种属的同源基因存在多拷贝现象。
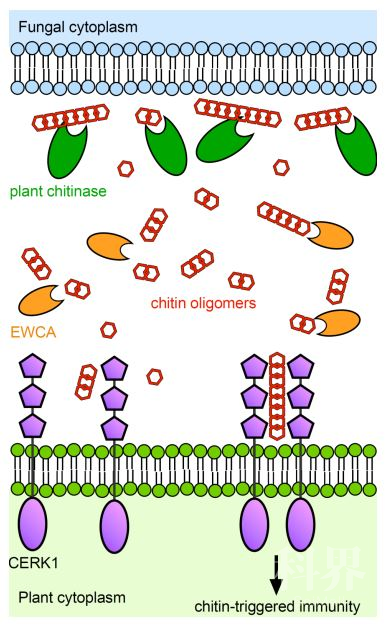
综上所述,该研究通过系统分析瓜类白粉病菌中的一类蛋白,综合运用生物信息学、生化、遗传学等手段,证实了EWCAs是一类几丁质酶类效应子,该类蛋白主要作用于几丁质诱导的植物免疫,并且广泛分布在不同的真菌中,加深了我们对植物病原真菌侵染宿主手段多样性的认识,为我们深入研究宿主与病原真菌互作提供了借鉴。
参考文献:
【1】Jones, J.D., and Dangl, J.L. (2006). The plant immune system. Nature 444, 323–329.
【2】Young, VL, Simpson, RM, and Ward, VK. (2005). Characterization of an exochitinase from Epiphyas postvittana nucleopolyhedrovirus (family Baculoviridae). J Gen Virol 86, 3253-3261
【3】de Jonge, R, van Esse, HP, Kombrink, A, Shinya, T, Desaki, Y, Bours, R, van der Krol, S,Shibuya, N, Joosten, MHAJ, and Thomma, BPHJ. (2010). Conserved fungal LysM effector Ecp6 prevents chitin-triggered immunity in plants. Science 329, 953-955
【4】Krokeide, IM, Synstad, B, Gåseidnes, S, Horn, SJ, Eijsink, VG, and Sørlie, M. (2007). Natural substrate assay for chitinase using high-performance liquid chromatography: a comparison with existing assays. Anal Biochem 363, 128-134
【5】de Jonge, R, van Esse, HP, Kombrink, A, Shinya, T, Desaki, Y, Bours, R, van der Krol, S, Shibuya, N, Joosten, MHAJ, and Thomma, BPHJ. (2010). Conserved fungal LysM effector Ecp6 prevents chitin-triggered immunity in plants. Science 329, 953-955
【6】van den Burg, HA, Harrison, SJ, Joosten, MH, Vervoort, J, and de Wit, PJ. (2006). Cladosporium fulvum Avr4 protects fungal cell walls against hydrolysis by plant chitinases accumulation during infection. Mol Plant Microbe Interact 19, 1420-1430
【7】Mentlak, TA, Kombrink, A, Shinya, T, Ryder, LS, Otomo, I, Saitoh, H, Terauchi, R, Nishizawa, Y, Shibuya, N, Thomma, BPHJ, and Talbot, NJ. (2012). Effector-mediated suppression of chitin-triggered immunity by Magnaporthe oryzae is necessary for rice blast disease. Plant Cell 24, 322-335.
【8】Sánchez-Vallet, A, Saleem-Batcha, R, Kombrink, A, Hansen, G, Valkenburg, DJ, Thomma, BP, and Mesters, JR. (2013). Fungal effector Ecp6 outcompetes host immune receptor for chitin binding through intrachain LysM dimerization. Elife 2, e00790
来源:bioartplants BioArt植物
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3ODY3MDM0NA==&mid=2247502471&idx=1&sn=0f9ded10c5057b110079504f96f97b55
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
分子植物卓越中心揭示病原真菌抑制昆虫免疫的基因对基因机制
“超级真菌”来了?别吓坏自己
植物逆境中心揭示植物感受鞭毛的新型免疫受体

Nature解释植物的气孔免疫
植物免疫机制研究取得进展

分子植物卓越中心发现真菌利用小RNA抑制蚊虫免疫反应新机制
分子植物卓越中心揭示果蝇行为免疫防御真菌感染的互作机制
Nature Plants:植物根部共栖微生物调节植物免疫反应,避免过度免疫

美国爆发的“超级真菌”不会感染健康人?专家解答哪些人群易被感染

分子植物卓越中心等揭示植物免疫信号和细菌免疫通路交叉及相互激活的机制