科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-03-10
操控纳米级构筑基元组装成高度有序的晶体结构已引起科研人员的研究兴趣。通过优化无机纳米颗粒的类型、尺寸、晶格参数和晶体对称性,可在热力学或动力学上调控其自组装过程,进而获得一元、二元和三元的晶体结构。源于高度有序排列所产生的新兴特性和多样的化学功能,这些自组装结构在催化、磁学、光学和功能生物材料等领域具有广泛的应用前景。以功能蛋白为基元结构精确构建结构可调的周期阵列是有趣的研究方向,然而,蛋白质表面的化学和结构复杂性,特别是对于非球形蛋白质模块而言,如何将各向异性的蛋白质基元可控组装成具有可调结构特性的蛋白质晶体仍是主要挑战。
近日,中国科学院苏州纳米技术与纳米仿生研究所研究员强斌团队利用一种各向异性的L-鼠李树胶糖-1-磷酸醛缩酶(RhuA)作为构筑基元,通过在蛋白质三维(3D)空间位点引入组氨酸残基并精确调控其相互作用,实现了将各向异性的非球形RhuA蛋白质自组装成高度有序的、具有不同形态和结构的蛋白质晶体。基于组氨酸的π -π作用,通过热力学调控RhuA的自组装过程,获得了3D纳米带和3D四方相晶体结构;通过引入强的金属离子-组氨酸螯合作用,从动力学上调控了RhuA自组装成3D四方相晶体结构。此外,通过在RhuA模块表面上设计另一种组氨酸的排布,进一步构建出RhuA蛋白质双螺旋3D超结构。利用荧光显微镜、透射电子显微镜(TEM)、原子力显微镜(AFM)和小角度X射线散射(SAXS)测定了它们的结构性质和动态组装性质。该研究旨在拓展可调控、高度有序的蛋白质超结构可编程的工具盒,有助于理解蛋白质界面相互作用机制。
相关研究成果以Noncovalent Self-Assembly of Protein Crystals with Tunable Structures为题,发表在Nano Letters上(DOI: 10.1021/acs.nanolett.0c04587)。
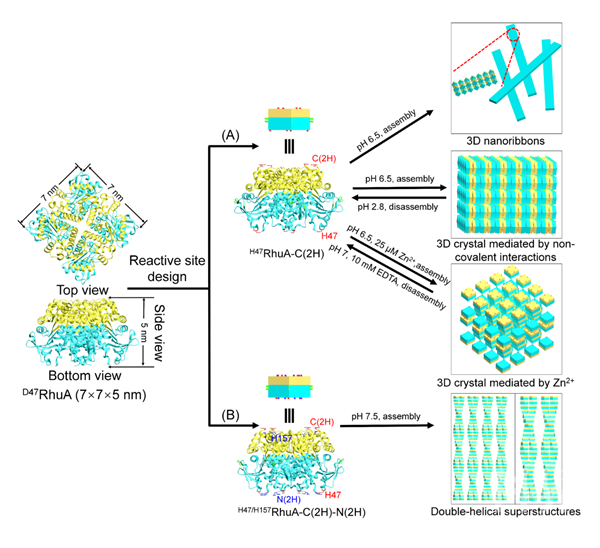
3D纳米带、3D蛋白质晶体和双螺旋蛋白质超结构形成的示意图。(A)设计H47RhuA-C(2H) 变体,在非共价相互作用的介导下自组装形成3D纳米带和两种类型3D晶体结构;(B)设计H47/H157RhuA-C(2H)-N(2H) 变体,在非共价相互作用介导下自组装形成双螺旋3D超结构
来源:中国科学院
原文链接:http://www.cas.cn/syky/202103/t20210310_4780185.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
蛋白质浓度测定

煮粥、炖肉那层泡沫到底要不要撇掉?90%的人都做错了

自然中不存在的蛋白质也能人造了!撼动材料医药界
蛋白质生物芯片

新研究发现影响哮喘的关键蛋白质

靶向探针精确操纵蛋白质
苍蝇体内独特蛋白质相当人类中间丝状蛋白质
MCP:高等植物拟南芥蛋白质热稳定性的蛋白质组学分析
脑蛋白质代谢显像

鸡蛋也能生产人类蛋白质了