科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-04-27

关注我们,获取更多相关资讯
年龄依赖的视网膜黄斑变性疾病(Age-related macular degeneration,AMD)会严重影响病人的视力,预估到2040年全球将会有2.88亿人受到该疾病的影响【1】。除此之外,黄斑营养不良(Macular dystrophies,MD)与AMD类似,也与网膜色素上皮细胞-绒毛膜复合体(Retinal pigment epithelium-choriocapillaris,RPE-CC)出现功能性异常有关【2, 3】。目前关于RPE-CC复合体在动物模型中已经对AMD/MD的疾病进展以及致病机理等方面的研究提供了重要的工具【4】,但是RPE-CC复合体的体外培养模型的还很缺乏,尚未建立能够很好地概括体内RPE-CC复合体的关键特征,比如三维细胞组织结构以及绒毛膜中的脉管系统。
2021年3月29日,来自美国罗彻斯特大学的Ruchira Singh研究组在Cell Stem Cell杂志上发表题为3D iPSC modeling of the retinal-pigment-epithelium-choriocapillaris complex identifies factors involved in the pathology of macular degeneration的文章,通过三维视网膜色素上皮细胞-绒毛膜复合体诱导多能干细胞模型确定参与病理黄斑病变的具体因子,并且首次建立了病人来源的3D视网膜色素上皮细胞模型。

体内RPE-CC复合体由RPE单层细胞覆盖在有孔绒毛膜脉管网络上。来自周围眼间质的视网膜色素上皮细胞、内皮细胞以及间充质细胞对体内RPE-CC复合物的发育至关重要。因此,作者们将人诱导多能干细胞来源的视网膜色素上皮细胞、内皮细胞以及间充质细胞加入到构建体外RPE-CC复合物模型系统之中(图1)。绒毛膜脉管网络包被在聚乙二醇的水凝胶之中,可以确保脉管系统指导实验进行到Day60时仍然稳定存在。水凝胶包裹的内皮细胞形成于单层间充质干细胞之上,以模拟眼间质对RPE-CC复合体的支持。通过对该体外模型中特异性细胞标记物的免疫染色,作者们确认了该三维体外培养提供可以精准地概括RPE-CC复合体的多种重要的生理特征。另外,作者们确认通过该三维体外培养系统证明其中的分泌因子足以支持绒毛膜复合物类似的脉管系统的发育。
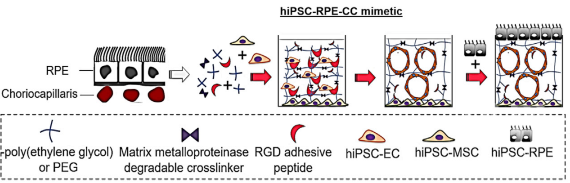
图1. 构建体外RPE-CC复合物模型的示意图
为了通过该体外模型进一步地探究调节RPE-CC复合体发育的旁分泌因子,作者们对视网膜色素上皮细胞以及间充质细胞中特异性调节因子的水平进行了检测。作者们发现VEGF-A分泌的水平在视网膜色素上皮细胞中较高,而TGF-β1则在间充质细胞中较高。为了这两种分泌因子的功能进行检测,作者们分别使用了这种分泌因子的中和抗体进行处理。中和抗体处理后可以发现绒毛膜复合物类似的脉管系统细胞出现了明显的降低。因此,分泌因子VEGF-A以及TGF-β1对于该体外系统中脉管系统的发育非常关键。
进一步地,作者们希望对该三维体外模型作为疾病模型的潜能进行检测。作者们发现视网膜色素上皮细胞功能障碍所导致的分泌因子的改变会直接导致绒毛膜细胞的萎缩。为了对绒毛膜细胞中脉管系统萎缩这一病理性特点进行研究,作者们进一步使用了从索斯比眼底营养不良症(Sorsby’s fundus dystrophy,SFD)病人体内诱导产生的多能干细胞建立体外三维模型。SFD主要是由组织金属蛋白酶抑制因子基因TIMP3中的突变造成的【5】。TIMP3是人类视网膜色素细胞以及内皮细胞中基质金属酶蛋白活性的关键调节因子【6, 7】。作者们发现在该体外三维模系统中引入SFD病人体内视网膜色素细胞特异性TIMP3的突变足以驱动绒毛膜复复合体脉管系统以及脉络丛新生血管的萎缩。因此,作者们的工作首次建立了病人来源的视网膜色素细胞-绒毛膜细胞复合体的体外三维模型。
先前的研究表明,可以通过抑制促血管形成的信号通路作为AMD以及SFD的治疗手段。为了验证该体外系统作为药物靶点筛选的有效性,作者们对在病人来源的三维视网膜色素细胞-绒毛膜细胞复合体模型中加入促血管形成的信号通路中FGF2因子的中和抗体进行处理,发现加入的中和抗体可以抑制内皮细胞的侵入。除了促血管生成的因子,基质金属蛋白酶也是调节血管的重要因子。基质金属蛋白广谱抑制剂可能是重要的可以挽救脉络丛新生血管改变的治疗手段。因此,通过建立该三维体外系统,为作者们确定FGF2和基质金属蛋白酶作为AMD/MDs的潜在治疗靶点提供了重要平台。
总的来说,该工作首次建立了能够在体外概括年龄依赖的视网膜黄斑病变等疾病的特征的三维组织系统,同时也建立了病人来源的诱导多能干细胞三维体外系统,为AMD/MD等疾病的病理性机制研究以及药物靶点的筛选提供了新颖的工具。
原文链接:
https://doi.org/10.1016/j.stem.2021.02.006
参考文献
1. Wong, W. L. et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. The Lancet. Global health 2, e106-116, doi:10.1016/s2214-109x(13)70145-1 (2014).
2. Hageman, G. S. et al. An integrated hypothesis that considers drusen as biomarkers of immune-mediated processes at the RPE-Bruch's membrane interface in aging and age-related macular degeneration. Progress in retinal and eye research 20, 705-732, doi:10.1016/s1350-9462(01)00010-6 (2001).
3. Roth, F., Bindewald, A. & Holz, F. G. Keypathophysiologic pathways in age-related macular disease. Graefe's archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie 242, 710-716, doi:10.1007/s00417-004-0976-x (2004).
4. Benedicto, I. et al. Concerted regulation of retinal pigment epithelium basement membrane and barrier function by angiocrine factors. Nature communications 8, 15374, doi:10.1038/ncomms15374 (2017).
5. Weber, B. H., Vogt, G., Pruett, R. C., Stöhr, H. & Felbor, U. Mutations in the tissue inhibitor of metalloproteinases-3 (TIMP3) in patients with Sorsby's fundus dystrophy. Nature genetics 8, 352-356, doi:10.1038/ng1294-352 (1994).
6. Ruiz, A., Brett, P. & Bok, D. TIMP-3 is expressed in the human retinal pigment epithelium. Biochemical and biophysical research communications 226, 467-474, doi:10.1006/bbrc.1996.1379 (1996).
7 Bugno, M. et al. Reprogramming of TIMP-1 and TIMP-3 expression profiles in brain microvascular endothelial cells and astrocytes in response to proinflammatory cytokines. FEBS letters 448, 9-14, doi:10.1016/s0014-5793(99)00323-3 (1999).
来源:BioArt
end

扫码关注我们
微信:CSCB-Wechat
微博:@中国细胞生物学学会
网址:www.cscb.org.cn
来源:CSCB-WeChat 细胞世界
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3ODMwOTAzNQ==&mid=2653518320&idx=2&sn=cc44aaf44e1a9dd430bd10d53c34df1c
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn