科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-05-05
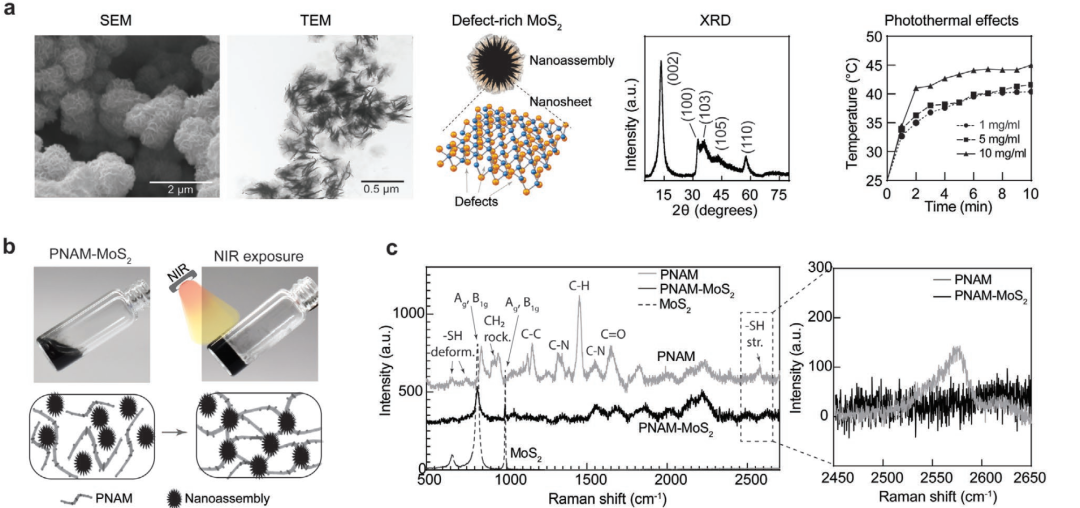
光响应水凝胶是一种新兴的生物材料,可用于各种生物医学应用,包括光热/光动力治疗,再生医学和增材制造等。长波长近红外光(NIR)具有较高的穿透深度(>四倍),比紫外线和可见光更能穿透厚的生物标本(≈8mm)而不影响周围的细胞。因此,近红外光可用于控制皮肤下的光响应材料的时空分布。然而,目前只设计一个三维水凝胶网络的NIR触发聚合的方法少有报道。
动态聚合物-纳米颗粒相互作用可用于工程原位形成水凝胶。基于聚合物和纳米颗粒固有的疏水或静电特性,一系列自组装原位形成水凝胶被开发出来。疏水改性可以提高聚合物链对疏水纳米粒子的吸附。受这些设计的启发,可以通过光等外部刺激来控制聚合物和纳米颗粒的疏水性。这种原位凝胶方法可导致交联网络的形成,以延长药物的局部保留或按需释放,用于再生药物和药物递送。
基于以上研究,Akhilesh K. Gaharwar团队提出通过结合NIR响应性二硫化钼(MoS2)与温度响应性聚(n -异丙基丙烯酰胺)(PNIPAm)网络来实现原位凝胶化,如示意图所示。二硫化钼是一类新兴的二维纳米材料,被称为过渡金属二硫族化合物。相对于石墨烯,二硫化钼纳米片具有很强的近红外吸收能力,因此被广泛用于光热治疗。此外,钼是亲硫的,而硫对形成二硫键有很强的亲和力。二硫化钼纳米粒子中原子缺陷的增加可以提供更活跃的结合中心与巯基化聚合物形成水凝胶。因此,通过设计MoS2纳米片中的缺陷,可以将硫醇功能化的PNIPAm偶联,并利用光引发的相变获得原位交联水凝胶(示意图1)。PNIPAm的侧基包含亲水性-CONH-和疏水性-CH(CH3)-基团。在高于较低临界溶液温度(LCST)下,PNIPAm水凝胶可以通过排出水从亲水状态过渡到疏水状态,这种相变行为源于侧基的亲水/疏水性能的动态变化。

Scheme 1. 富含缺陷的MoS2纳米粒子的合成和PNAM–MoS2水凝胶的原位凝胶化。
因此,近红外辐射通过利用MoS2的光热特性和热反应聚合物的固有相变能力激活聚合物与纳米材料的动态相互作用。具体而言,在NIR照射下,随着温度的升高,MoS2纳米粒子与PNIPAm链的疏水相互作用增强。此外,在近红外辐射下二硫化钼纳米粒子产生热量,使硫化PNIPAm链包裹,此时纳米二硫化钼的缺陷与硫醇侧基快速反应形成共价键。研究表明,NIR触发的原位凝胶可在体外和体内实现。此外,交联凝胶显示出近红外光响应药物释放的能力,如图1所示。
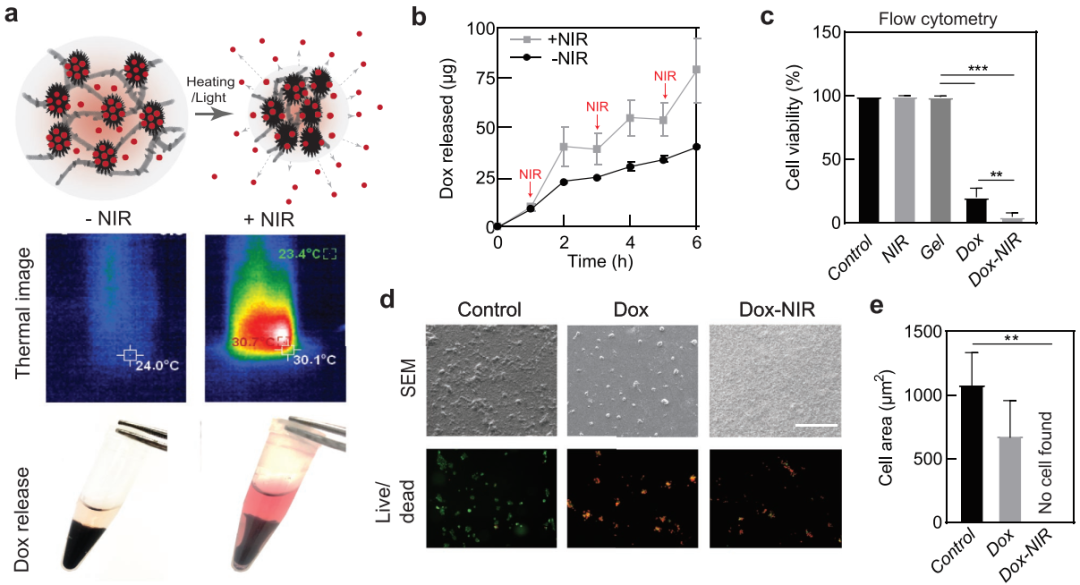
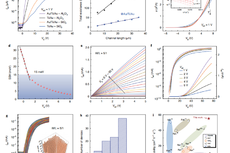
Figure 1 通过近红外照射促进药物传递。a)光或温度触发PNAM-MoS2网络药物释放示意图。近红外激光辐照PNAM-MoS2水凝胶的热成像。温度升高时,PNAM-MoS2水凝胶的形状发生了变化LCST PNAM。b) NIR触发药物释放3个周期,10min NIR照射1个周期。c)流式细胞术观察组合化疗光热治疗对MCF-7细胞活力的影响。d)扫描电镜和活/死成像图。e)扫描电镜样品上细胞面积的定量。
结论: 作者报道了一类基于MoS2纳米粒子和硫醇功能化热响应聚合物动态相互作用的光响应原位凝胶体系。当低粘度前驱体溶液(MoS2纳米粒子和热响应聚合物)暴露在近红外光下时,聚合物和纳米粒子之间的化学共轭和物理吸收导致机械交联水凝胶的形成。首次了报道使用近红外光启动自组装水凝胶的凝胶化,而不需要其他试剂。在近红外光照射下,在体外和体内均证实了原位凝胶化的二硫化钼水凝胶。此外,在水凝胶网络中嵌入的二硫化钼纳米粒子可被用作药物载体。这类光响应生物材料在一系列生物医学应用,包括人工肌肉、智能驱动器、3D/4D打印、再生医学和治疗递送方面表现出具有强大的潜力。
全文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202101238
来源:高分子科学前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5NjM5NzA5OA==&mid=2651786137&idx=5&sn=5d2b25ff772d5955d9f92ba171f07f58
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

新型碗状碳胶囊-二硫化钼纳米片高性能超级电容器材料

中国科学院海洋研究所深海高温热液喷口流体原位拉曼定量探测获新进展
“求同存异”的单原子钴-二硫化钼纳米酶

逆转时间箭头:时光也许可以倒流,但仅限微观粒子

为何卢浮宫博物馆地下有台粒子加速器?
揭示二硫化钼中晶界在催化析氢中的重要作用

二维二硫化钼催化动力学生长:气-液-原子-固态(VLAS)生长机理

Nature子刊:二硫化钼晶界对催化析氢重要作用!
中科院研制二硫化钼大面积柔性透明电子器件

【每日科技速递】《综合防控儿童青少年近视实施方案》出台:实施网络游戏总量调控