科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-05-08
卵母细胞作为雌性哺乳动物的生殖细胞,其有序发育受到复杂而精细的内部以及外部调控,以保证动物后代繁衍的质量 [1]。而卵母细胞的在体发育是以卵泡为结构基础的,在卵泡中卵母细胞形成致密的透明带结构对自身进行保护,但也将卵母细胞和周围颗粒细胞的直接交流进行阻隔 [2]。那么,卵母细胞是如何克服透明带阻隔,进而调控卵泡的发育和雌性有序生育呢?
2021年5月5日,中国农业大学生物学院的张华教授团队(张焱副教授和王也博士为共同第一作者)在Nature Communications 在线发表了题为“Oocyte-derivedmicrovilli control female fertility by optimizing ovarian follicle selection inmice”的研究文章,该研究采用基因修饰动物与高分辨显微技术相结合的手段,发现了哺乳动物卵母细胞起源的独特微绒毛系统 (Oo-Mvi),并阐明了其介导卵母细胞分泌因子(oocyte secreted factor,OSFs) 的释放,进而精细调节卵泡发育和雌性生殖寿命的功能[3]。

在本研究中,张华团队采用细胞膜示踪的基因修饰荧光报告小鼠,对小鼠卵母细胞透明带中的微绒毛进行了系统的观察与探索。结果发现,透明带中同时存在着两种细胞来源的微绒毛结构,一种为领域中广为熟知的颗粒细胞来源的跨透明带凸起 (granulosa cell transzonal projections, GC-TZPs), 另一种则为卵母细胞来源的数量相对较少且顶端带有膨胀的囊泡的“蘑菇”状微绒毛 (oocyte microvilli, Oo-Mvi)(图1)。进一步的,该研究利用高精度活细胞成像技术发现Oo-Mvi在卵母细胞表明存在着一系列的特异性细胞行为, 如小泡的动态破裂,提示了Oo-Mvi可能是卵母细胞调控外界微环境的相关结构。
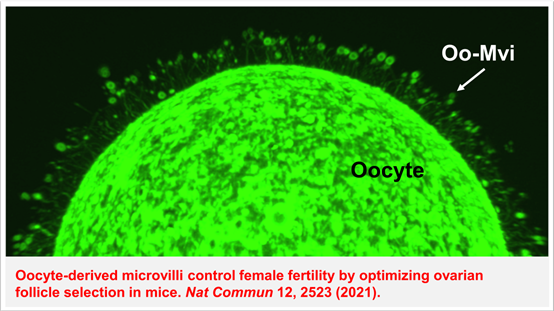
图1卵母细胞膜示踪基因修饰荧光报告小鼠结合高分辨成像所观察到的卵母细胞表面 “蘑菇”状微绒毛结构
接下来,该研究通过对透明带进行蛋白质谱分析中获得的高表达的绒毛形成相关蛋白Radixin [5]进行卵母细胞特异性敲除,进而发现卵母细胞缺失Radixin(Rdx)基因导致卵母细胞表面微绒毛结构缺失,而雌性小鼠产生包括卵母细胞及卵泡发育迟缓、GC-TZP构建失败、卵巢中卵泡加速丢失,最终导致雌性卵巢早衰的一系列生育障碍。进一步的机制研究发现,卵母细胞调控卵泡发育的关键性分泌因子GDF9可以特异性富集在Oo-Mvi的小泡结构中,并且Rdx敲除小鼠卵母细胞中的GDF9等分泌因子因无法外排而产生了堆积的现象,相关实验证实了Oo-Mvi具有富集并介导卵母细胞分泌因子高效排放,进而参与调控卵泡发育及雌性生育寿命的功能。
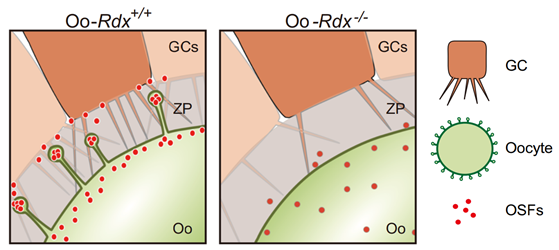
图2 卵母细胞微绒毛功能模式图
上述工作,首次揭示了哺乳动物卵母细胞精细调控卵泡发育的结构基础,并为卵泡发育及选择中的两细胞对话系统提供了关键的拼图。通过本研究,明确了在卵泡发育过程中,卵母细胞透明带中的微绒毛通过调节卵母细胞-颗粒细胞的有序而高效的通讯,进而优化卵泡的发育命运,平衡卵巢内卵泡的生存和死亡已到达选择最优卵泡进行发育,为后代繁育提供最优卵母细胞的目标(图2)。
参考文献:
[1]Matzuk, M. M., Burns, K. H., Viveiros, M. M. & Eppig, J. J. Intercellularcommunication in the mammalian ovary: oocytes carry the conversation. Science296, 2178-2180 (2002). DOI: 10.1126/science.1071965
[2]Wassarman, P. M. & Litscher, E. S. Biogenesis of the mouse egg'sextracellular coat, the zona pellucida. Curr. Top. Dev. Biol.102, 243-266 (2013).DOI:10.1016/B978-0-12-416024-8.00009-X
[3]Zhang, Y., et al. Oocyte-derived microvilli control female fertility byoptimizing ovarian follicle selection in mice. Nat. Commun. (2021).DOI: 10.1038/s41467-021-22829-2
[4]El-Hayek, S., Yang, Q., Abbassi, L., FitzHarris, G. & Clarke, H. J.Mammalian oocytes locally remodel follicular architecture to provide thefoundation for germline-soma communication. Curr. Biol. 28,1124-1131 (2018). DOI: 10.1016/j.cub.2018.02.039
[5]Yonemura, S. & Tsukita, S. Direct involvement of Ezrin/Radixin/Moesin(ERM)-binding membrane proteins in the organization of microvilli incollaboration with activated ERM proteins. J. Cell Biol. 145,1497-1509 (1999). DOI: 10.1083/jcb.145.7.1497
参考消息:
https://www.nature.com/articles/s41467-021-22829-2
来源:iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247526291&idx=6&sn=38d5d47c2d10a4336a6ea9331d5576cf
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
动物所发现特异调控卵母细胞减数第一次分裂的细胞周期蛋白
NEJM报道全球最罕见的双胞胎类型:由两个精子进入同一个卵母细胞产生

Nat Comm: 组蛋白去乙酰化酶3调控卵母细胞成熟分子机制

Cell子刊:中国科学家化学重编程体细胞形成卵母细胞,具有治疗不孕的潜力
小鼠卵母细胞减数分裂成熟过程中的代谢模式特征
我国科研人员揭示决定卵母细胞质量的新机制
PNAS | 上海交通大学医学院孙赟/杜艳芝/魏延昌团队成功评估特定甲基化

线粒体质量控制与卵母细胞发育

NEJM:报道全球最罕见的双胞胎类型:由两个精子进入同一个卵母细胞产生

中国首批“试管狗”在北京诞生