科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-05-28
2021年5月26日,国际学术期刊《Cell Reports》杂志在线发表了周政课题组与中科院物理所李伟课题组合作完成的研究论文“Recognition of the inherently unstable H2A nucleosome by Swc2 is amajor determinant for unidirectional H2A.Z exchange”。该项研究发现SWR1的重要亚基Swc2具备特异识别并感知底物H2A核小体的能力,进而揭示了SWR1催化H2A.Z替换H2A的过程中维持反应单向性的分子机理。
H2A.Z是组蛋白H2A的一类变体。酵母及哺乳动物细胞中的H2A.Z具有高度保守的序列,并且在基因转录、DNA复制、基因组稳定性维持等过程中发挥重要作用。H2A.Z通过精确定位于基因组的特定位点来改变染色质结构并实现其功能。SWR1/SRCAP催化的H2A.Z替换反应可以将H2A.Z核小体精准地定位到正确的染色质区域,又被称为“核小体编辑”。中科院生物物理所周政课题组近年来围绕该课题开展了系统研究,先后探明了SWR1/ SRCAP介导H2A.Z进入核小体(Nat Struct Mol Biol, 2016),以及将H2A移出核小体(PNAS, 2020)的过程;发现了组蛋白伴侣介导H2A.Z进行染色质递送(PLoS Biol, 2019)以及染色质移除(Cell Res, 2014)的方式,从而初步阐明了SWR1/ SRCAP与组蛋白形式的H2A.Z进行作用的分子机制。然而,仅有组蛋白形式的H2A.Z并不能激活SWR酶体进行H2A.Z替换,H2A.Z替换还需要H2A核小体这个关键的激活因子。SWR1/SRCAP如何区分底物与产物,以确保H2A.Z交换反应单向性的内在机制尚不清楚。
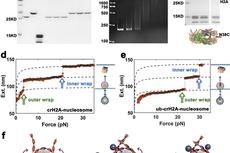
在该研究中,研究人员首先利用溶液核磁共振技术鉴定出酵母SWR1重要亚基Swc2的N端结构域(Swc2-Z)可以特异识别底物H2A核小体,并发现Swc2-Z通过其高度保守的RXXR基序与核小体酸性口袋相互作用。随后,研究人员利用单分子磁镊技术系统研究了H2A核小体与H2A.Z核小体的去组装/组装动力学过程,以及Swc2对该过程的影响。研究人员发现底物H2A核小体的结构稳定性显著低于H2A.Z核小体,同时Swc2-Z可以特异感知处于低稳定性的H2A核小体,并具备促进其去组装的能力。在此基础上,通过单分子磁镊、X射线晶体学、凝胶迁移、以及热稳定性测定等实验,研究人员证实位于H2A M4区域的三个H2A特有残基(G47、P49和I63)调控H2A核小体处于低稳定性水平,并在Swc2介导的H2A核小体去组装中发挥关键作用,将其替换为H2A.Z的对应残基后会破坏Swc2介导的H2A核小体去组装。体内与体外实验表明,Swc2-Z对于SWR1的催化活性,以及H2A.Z在转录起始位点的定位都具有重要作用。该研究提示,在SWR1复合物催化H2A.Z交换反应起始状态,Swc2-Z识别并感知具有内在低稳定性的H2A核小体,从而确保H2A.Z交换反应单向进行(图一)。此外,Swc2在高等真核细胞中的同源蛋白YL1能够发挥同样的功能,说明该机制在不同物种中具有保守性。本研究为阐明SWR酶体的功能以及“核小体编辑”的机制提供了重要基础。
中科院生物物理所周政研究员与中科院物理所李伟副研究员位本文的共同通讯作者。周政课题组戴霖昌博士与李伟课题组肖雪博士为本文的共同第一作者。周政课题组助理研究员潘露博士和冯晓利博士也参与了该项研究。中科院生物物理所朱冰研究员和张珠强研究员为本研究提供了重要帮助。该研究获得国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项(B类)等资助。
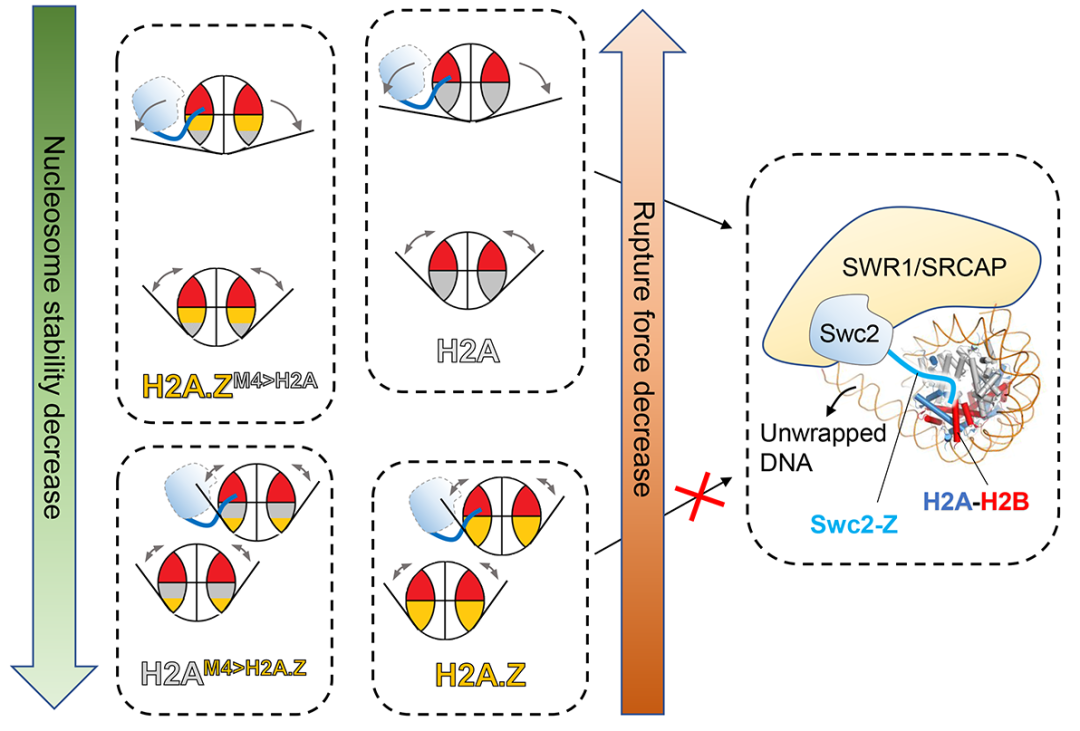
图一、Swc2识别稳定性低的H2A核小体并促进其开放并实现H2A.Z交换。箭头方向和大小分别表示核小体DNA的开放和关闭及其程度大小
文章链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(21)00528-3
来源:中国生物技术网
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5ODU5NDgyMg==&mid=2653968495&idx=6&sn=3fba6d1bc0a880eebf573fd17e5f4522
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

研究揭示组蛋白H2A泛素化修饰对核小体的调控机制
NAR | 李祥/刘政等揭示琥珀酰化对于核小体和染色质动态结构的影响

章冰团队等运用全蛋白组数据为癌症治疗提供更精准的方案
Cell:染色质激活或抑制状态决定了核小体分离的差异性
【科技前沿】周政/朱平合作揭示开放核小体导致染色质松散的分子机制
研究揭示组蛋白H2A泛素化修饰对核小体的调控机制

染色质状态及核小体分布调控共转录剪接过程
生物物理所揭示开放核小体导致染色质松散的分子机制

Nature: 核小体构象变化与异染色质相分离

揭示核小体结构对组蛋白修饰酶复合物的酶活调控及其分子机制