科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-22
来源:X一MOL资讯
近日,香港浸会大学黄嘉良教授课题组在开发EBNA1(Epstein-Barr nuclear antigen 1)靶向性小分子探针用于EBV(Epstein-Barr Virus)阳性肿瘤治疗方面取得了新进展。该工作为特异性治疗EBV阳性肿瘤提供了新策略——通过靶向EBV独有的潜伏蛋白EBNA1从而激活EBV裂解式感染。该论文已在著名杂志《美国科学院院刊》(PNAS)上在线发表。
近年来,黄嘉良教授课题组围绕着EBNA1靶向性小分子探针在EBV阳性肿瘤成像和治疗等生物医药领域展开了一系列原创性研究并取得了不俗的成果(Chem. Commun., 2014, 50, 6517-6519; Nat. Biomed. Eng., 2017, 0042; Theranostics, 2018, 8, 5307-5319)。EBV是一种普遍存在的人类疱疹病毒,感染全世界超过95%的人口。在感染后,EBV能够在宿主体内建立终身的潜伏感染,这种潜伏感染跟多种淋巴癌和上皮癌密切相关。EBNA1是唯一在所有EBV阳性肿瘤中表达的病毒蛋白。作为一种同型二聚体,其二聚化对病毒基因组的维持具有关键作用。基于此,特异性靶向潜伏蛋白EBNA1,竞争性干扰EBNA1二聚体的形成并削弱其功能,将可能实现对EBV阳性肿瘤的生长抑制,这是该项工作的理论基础和核心。
在前期工作的基础上,考虑到EBNA1 UR1的“锌指结构”(一种通过螯合Zn2+而形成的蛋白质结构,该结构参与EBNA1的转录功能),该团队在探针结构中进一步引入Zn2+螯合剂,设计构建了对Zn2+和EBNA1蛋白具有双重荧光响应性的分子探针(图1)。研究发现,探针ZRL5P4通过靶向EBNA1蛋白以及竞争性的结合Zn2+,削弱了EBNA1由“锌指”结构介导的多聚体形成以及EBNA1的转录激活能力。这种同时针对EBNA1二聚化和多聚化的抑制,增强了探针在EBV阳性肿瘤中的细胞毒性。有趣的是,通过对ZRL5P4处理过的肿瘤组织切片分析,可以观察到多个EBV裂解蛋白的表达以及EBV病毒颗粒的释放,而且被释放的病毒颗粒具备再感染细胞的能力。这些结果表明ZRL5P4通过靶向EBV病毒蛋白EBNA1并干扰其“锌指”结构功能,特异性的诱导了EBV从潜伏式感染转变为裂解式感染,最终导致被感染细胞的死亡。这种感染模式的转变也是一种针对病毒性疾病的治疗方式,然而就EBV来说,现有的裂解诱导剂一般是化学激活剂,包括已经进入临床I期和II期试验的激活剂,它们缺乏对EBV的特异性,因而在临床实验中会表现出副反应,影响疗效。这项研究开发了首例EBV特异性的裂解诱导剂,能够诱导EBV从潜伏式感染转变为裂解式感染,有希望运用在今后的EBV阳性肿瘤的裂解诱导疗法中。
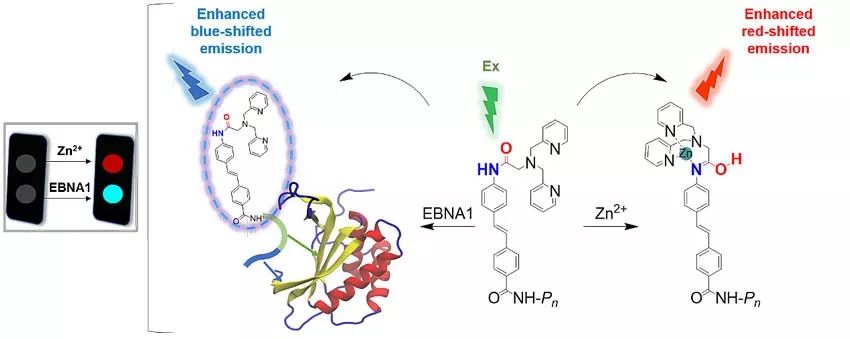
图1 探针结合Zn2+和EBNA1蛋白的双重荧光响应性示意图。
该探针ZRL5P4已被独家授权给创延生物医药科技有限公司(BP InnoMed Limited),并正在进行临床前试验和临床试验准备。
文章的第一作者是香港浸会大学化学系的江丽君博士、生物系的龙康乐博士、中医药学院的黄韬博士以及深圳大学基础医学院的蓝荣峰博士,通讯作者是香港浸会大学化学系的黄嘉良教授、帝国理工学院的Nicholas Long教授、香港浸会大学生物系的麦乃岐教授和龙康乐博士、以及香港理工大学应用生物及化学科技学系的罗嘉丽博士。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657625576&idx=4&sn=a1d4247c7221d9fd4bc315c0cd6813fc&chksm=80f80c38b78f852e55e33ebd810d0e7004a8b7c8f7e0b247c3c12b10a73350cfd848554b8c3c&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

滴血检测肿瘤将成为可能!特异性达到90%以上

中年人要担心的不只是油腻,45岁起就该开始结直肠癌筛查

【每日科技速递】国家发展改革委:大力推动营商环境改善

肿瘤引流淋巴结抗原特异性记忆CD8T细胞的研究

【科学普及】双特异性抗体那些事儿
胰腺特异性抗原(PaA)

全新给药方式可降低癌症复发率

华中农业大学:巧用天然辣椒素实现特异性肿瘤治疗

植物特异性非编码RNA功能分析
Nat Nanotechnol | 纳米颗粒实现器官特异性基因编辑!