科技工作者之家
加好友
科技工作者之家 2021-06-11
2021 年 6 月 1 日,浙江大学转化医学研究院吕志民教授、浙江大学口腔医学院陈谦明教授与四川大学华西口腔医学院刘锐研究员(共同通讯作者)合作,在Molecular Cell 上在线发表了题为 Choline Kinase Alpha 2 Acts as a Protein Kinase to Promote Lipolysis of Lipid Droplets 的文章。胆碱激酶 α2(Choline Kinase α, CHKα2)的经典功能是参与卵磷脂合成的第一步,将胆碱(choline)磷酸化为磷酸胆碱(phospho-choline)用于细胞的膜结构的形成。该项研究发现了 CHKα2 的全新功能,即在能量不足时,诱发脂滴降解。

肿瘤细胞由于快速增殖,时常处于葡萄糖供给不足的「饥饿」状态,需要「开源」利用细胞内的其他储能物质以维持其快速增殖的需求。脂滴(lipid droplet,LD)是细胞内脂肪储存的主要场所。当葡萄糖充足时,脂肪酸合成旺盛,细胞会将多余的脂肪酸与甘油合成甘油三酯(TG),储藏于脂滴中;当葡萄糖不足时,细胞会利用脂类水解酶或通过自噬途径,分解甘油三酯,进而将脂肪酸输送到线粒体中,通过脂肪酸氧化(beta oxidation)提供能量。和正常细胞相比较,肿瘤细胞持续地合成和摄取大量脂质,并将多余的脂质储存于脂滴以备「饥饿」状态下提供能量。因此,肿瘤细胞有其独特的脂质合成、储存及利用的自我调控能力。
2020 年,吕志民团队在 Nature(2020, PMID: 32322062)发文,首次报道了肿瘤细胞脂质感应异常及脂质合成持续激活的重要机制。肿瘤细胞独特的信号通路使得糖异生途径代谢酶 PCK1 具有了新的非代谢酶功能,从而促进 SREBP 信号通路的激活及肿瘤细胞的脂质合成,以增强脂滴的形成。然而,肿瘤细胞如何在「饥饿」状态下启动脂滴的脂解仍不清楚。
肿瘤细胞能量缺乏时,被 AMPK 磷酸化和 KAT5 乙酰化的 CHKα2 能由细胞浆转位到脂滴表面,同时发挥了蛋白激酶功能,磷酸化脂滴表面蛋白 PLIN2/3,从而促进 PLIN2/3 被分子伴侣 HSC70 识别,使得 PLIN2/3 通过自噬途径被降解。失去 PLIN2/3 蛋白包被的脂滴暴露出内部的脂类分子,被脂类水解酶和自噬体降解,从而促进肿瘤发生发展。
本研究报道了一条新型的细胞响应能量应激,调控脂类代谢的信号路径,并阐释了 CHKα2 的代谢激酶与蛋白质激酶功能转换的分子机制。该研究不仅为癌症的个体化治疗揭示了新的代谢标记物和分子靶点,而且对靶向肿瘤脂代谢的药物研发具有重大的指导意义。
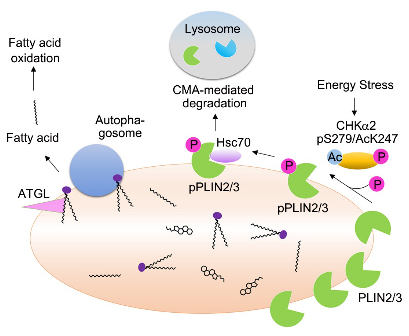
图文摘要
肿瘤的大量基因突变及特有的微环境,往往导致代谢酶原有的功能改变并赋予其新的非代谢酶功能。该研究是吕志民团队继发现糖代谢酶 PKM2(Cell,2012, PMID: 22901803;Molecular Cell, 2014, PMID: 24316223)、PGK1(Molecular Cell,2016, 2017, 2019, PMID: 26942675 , 28238651, 31492635)、KHK-A(Nature Cell Biology, 2016, PMID:2708854; Science Advances, 2019, PMID: 31032410)、PCK1(Nature, 2020, PMID: 32322062)的蛋白激酶活性在肿瘤发生中扮演重要作用之后,发现的第五个具有蛋白激酶活性的代谢酶。
这些突破性的研究进展,改变了业界对肿瘤代谢的传统认知,为肿瘤代谢领域的研究做出了突出贡献。
来源:生物学霸
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4OTQ1MTQxNg==&mid=2652111951&idx=4&sn=1a993a9d6b96b103473fe3439543bf69
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中国细胞生物学学会/上海市创新细胞生物学发展基金会2022年资助项目公示
植物细胞器pH调控细胞生物学功能研究获进展
辽宁省细胞生物学学会医用高分子与细胞生物学专业委员会首届学术会议在沈阳召开
2017年全国植物细胞生物学大会顺利召开




辽宁省细胞生物学学会分子诊断专业委员会胸部肿瘤基层MDT学组成立大会暨辽沈胸部肿瘤多学科论坛在沈阳 召开
细胞生物学: 模型原始细胞也许可预测原始细胞周期

【公示】中国细胞生物学学会/上海市创新细胞生物学发展基金会2021年资助项目公示

【活动预告】EMBO-CSCB Joint Webinar:细胞生物学研究前沿与论文发表

国际细胞生物学研究热点,你get到了吗?

【公示】细胞生物学领域高质量科技期刊分级目录结果公示