孙熙宸
加好友
孙熙宸 2019-12-30
来源:BioArt
帕金森病 (Parkinson’s disease) 患者的神经退行性变与路易小体 (Lewy bodie) 的形成有关【1】。Lewy bodies是由胞内α-突触核蛋白 (α-synuclein) 无序聚集起来的内含物。α-synuclein在胞内的聚集受到一些特殊的因子调节,包括翻译后修饰【2】,Abelson-kinase介导的磷酸化【3】以及与胞内如分子伴侣 (molecular chaperones) 之间的相互作用。然而,这些调控手段背后的具体机制还不是很清楚【4,5】。
2019年12月5日,来自瑞士巴塞尔大学的Sebastian Hiller教授带领的团队和苏黎世联邦理工大学的Roland Riek教授带领的团队在Nature 发表题为Regulation of α-synuclein by chaperones in mammalian cells的长文,在这里,研究人员系统地描述分子伴侣与α-synuclein在体内外的相互作用。他们发现6个结构高度不同的分子伴侣都能识别α-synuclein N端Tyr39附近的一段经典的基序 (motif,超二级结构) 。Tyr39磷酸化能直接破坏分子伴侣与α-synuclei的相互作用。如果特异性地抑制分子伴侣HSC70和HSP90β与α-synuclein的相互作用,会引起α-synuclein快速移位到线粒体,最终聚集。

研究人员首次对不同结构分子伴侣包括人HSC70,HSP90β和细菌SecB, Skp, SurA与α-synuclein的相互作用模式进行分析,发现它们识别α-synuclein的模式都是相同的。硫黄素T测定实验结果显示所有这些分子伴侣都能干扰α-synuclein的聚集。同时,HSP90抑制剂格尔德霉素 (geldanamycin) 和根赤壳菌素 (radicicol) 能减弱HSP90的干扰作用。结合核磁共振信号强度和化学位移扰动实验确定α-synuclein与分子伴侣相互作用区域在N端12个残基和Tyr39附近6个残基片段。这两个片段一直被认为是α-synuclein经典的分子伴侣相互作用motif。对分子伴侣而言,以HSC70为例,HSC70ADP和HSC70ATP形式都能与α-synuclein相互作用。这六个分子伴侣与α-synuclein相互作用的蛋白浓度都在100 μM,为了排除大分子聚集的非特异作用,研究人员以高浓度的BSA或泛素作了阴性对照。为了进一步确定分子伴侣与α-synuclein相互作用的生理作用,研究人员构建了∆N-α-synuclein突变体 (缺少N端10个残基),生物薄膜干涉 (Bio-layer Interferometry,BLI) 实验显示与野生型α-synuclein相比,突变体与分子伴侣相互结合的亲和力大大降低,说明α-synuclein的N端确实是相互结合位点的一部分。之前的报道认为分子伴侣与α-synuclein相互作用发生在细胞膜。但是研究人员分别在大肠杆菌,HEK293和MDCK-II 细胞的细胞质 (不含膜) 部分检测到经典的分子伴侣与α-synuclein 相互作用模式。同时,作者也在细胞膜部分检测到α-synuclein与磷脂双层膜 (lipid bilayer membranes) 之间存在相互作用。加入大单层脂质体 (large unilamellar vesicles,LUVs) 能破坏分子伴侣SecB与α-synuclein 的相互作用,这说明LUVs和SecB竞争性结合α-synuclein。也就是说,α-synuclein在膜结合和分子伴侣结合这两种互相竞争的状态间维持动态平衡。对哺乳细胞中α-synuclein的N端进行化学交联和质谱分析,蛋白相互组中含有大量分子伴侣。因此,研究人员提出一个新的假设,在哺乳细胞中,α-synuclein主要以分子伴侣结合的形式存在,而不是膜结合形式。
接下来,研究人员把3–10 μM 浓度的[U-15N]-α-Synuclein转入HEK293细胞,利用核磁共振实验来研究分子伴侣与α-synuclein在哺乳动物细胞中的相互作用。通常认为多个分子伴侣在细胞中的作用是相互重叠和冗余的,研究人员把HEK293细胞中的HSC70敲降后,核磁共振的信号强度确实和野生型一致。使用HSP90抑制剂后,核磁共振的信号强度明显增加,但是24小时后又完全消失。这说明HSP90在HEK293中确实和α-Synuclein相互作用,且这种作用在使用抑制剂后就消失。当同时使用结合能力最强的HSC70和HSP90抑制剂时,发现这种抑制作用比较温和,4小时后仍有大量的HSP90结合在α-synuclein,但是已经能在胞内观察到一部分游离的α-synuclein。然而24小时以后,却发现核磁共振信号强度大幅较少,且强度和之前在细菌中检测到的LUV膜结合模式相同。说明同时使用HSC70和HSP90抑制剂能引起瞬间的α-synuclein膜结合形式。在神经细胞或HEK293细胞中,分子伴侣的浓度远远大于α-synuclein的浓度。结合这部分实验结果说明,在哺乳动物细胞中,α-synuclein与胞内的分子伴侣瞬间结合,和α-synuclein与膜结合相比,占绝对主导优势。
另外,研究人员在同时使用HSC70和HSP90抑制剂的实验组中发现了许多由α-synuclein聚集形成的大分子。因此HSC70和HSP90抑制后引起的α-synuclein与细胞膜的相互作用可能是相关疾病发生的关键机制。分别用MitoTracker (线粒体marker),LysoTracker(酸性的囊泡如溶酶体marker)和 AlexaFluor 标记的麦胚凝集素AlexaFluor-labelled wheat germ agglutinin(质膜和内质网marker)与α-synuclein抗体共染免疫组化,结果显示,当抑制分子伴侣后,α-synuclein和线粒体有很强的共定位。免疫荧光实验也显示α-synuclein和线粒体marker CoxIV之间有很强的共定位。这部分实验结果说明,HSC70和HSP90抑制后,α-synuclein定位在线粒体。
α-synuclein的N端存在多种化学修饰,那么这些化学修饰是否会影响经典的分子伴侣与α-synuclein互作网络呢?N端乙酰化的α-synuclein是哺乳细胞中的主要存在形式。但是N端乙酰化并不影响分子伴侣与α-synuclein之间的相互作用。细胞氧化压力和ROS失衡是帕金森病的主要标志,会导致α-synuclein的氧化修饰。而N端1号位和5号位的甲硫氨酸被氧化后会破坏分子伴侣与α-synuclein之间的相互作用。对N端的几个酪氨酸进行磷酸化后,结果显示只有Tyr39的磷酸化才能破坏分子伴侣与α-synuclein之间的相互作用。与之一致的是,帕金森病进展过程往往伴随着Tyr39磷酸化的上调。
总之,这篇文章揭示了哺乳动物细胞中分子伴侣调控α-synuclein的功能机制。正常细胞中,α-synuclein主要以分子伴侣结合形式存在,若这种平衡被破坏,则会促进帕金森病的发展。α-synuclein在线粒体内的聚集会破坏线粒体膜,这与之前文献报道的线粒体损伤是帕金森病发生的重要因素一致。
原文链接:
https://www.nature.com/articles/s41586-019-1808-9
参考文献
1. M. Goedert, M. G. Spillantini, K. Del Tredici, and H. Braak, "100 years of Lewy pathology," Nature Reviews Neurology, vol. 9, pp. 13-24, 2013/01/01 2013.
2. K. J. Barnham, C. L. Masters, and A. I. Bush, "Neurodegenerative diseases and oxidative stress," Nature Reviews Drug Discovery, vol. 3, pp. 205-214, 2004/03/01 2004.
3. O. Hantschel and G. Superti-Furga, "Regulation of the c-Abl and Bcr–Abl tyrosine kinases," Nature Reviews Molecular Cell Biology, vol. 5, pp. 33-44, 2004/01/01 2004.
4. M. M. Dedmon, J. Christodoulou, M. R. Wilson, and C. M. Dobson, "Heat Shock Protein 70 Inhibits α-Synuclein Fibril Formation via Preferential Binding to Prefibrillar Species," Journal of Biological Chemistry, vol. 280, pp. 14733-14740, April 15, 2005 2005.
5. H. Dimant, D. Ebrahimi-Fakhari, and P. J. McLean, "Molecular chaperones and co-chaperones in Parkinson disease," The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, vol. 18, pp. 589-601, 2012.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479505&idx=3&sn=357e4e4cc2c9caeafc6aed884f6b18a4&chksm=84e233a5b395bab316ca80ac7ee8f662b0eb55976e73400d6473d644db550a4daf207922c10b&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
核磁共振成像可观察基因表达

做核磁共振时,为何体内不能有金属?

我首次实现零磁场核磁共振的普适量子控制
核磁共振氢谱
核磁共振波谱法
关于核磁共振波谱NMR的知识(原理、用途、分析、问题)
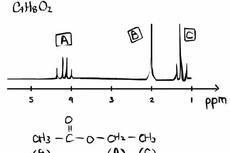
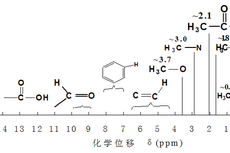
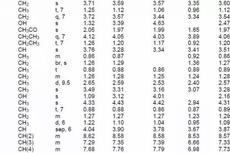
核磁共振成像(MRI)

科学家开发出固体核磁共振新方法

江苏省核磁共振论坛在中国(泰州)医药城举办
13碳核磁共振