科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-07-12
目前,用于研究恶性肿瘤的临床前模型主要是细胞系和患者源性的肿瘤异种移植。尽管其为肿瘤的研究做出贡献,但仍有缺陷。近年来,一个新兴起的领域—类器官,为肿瘤的研究提供了新的平台。类器官能够在体外高度重现体内肿瘤的原始特征,在药物研究、预测患者对治疗的反应以及为患者提供个性化医疗方案方面,拥有广阔的前景。目前,已经成功培养出如胃肠、肝、前列腺和乳腺等多种类器官。类器官的出现无疑给肿瘤的研究提供了更多的可能。
人类肿瘤较为复杂,不同的肿瘤患者对相同的临床治疗反应可能存在很大差异。目前,肿瘤进展的机制以及药物疗效和耐药的产生机制仍不明确。大量通过Ⅰ期药物安全性测试的抗癌药物在Ⅱ、Ⅲ期的疗效测试中被淘汰。因此,需要优化临床前疗效模型来改进对临床治疗反应的预测,降低临床试验的失败率。目前,正在使用的几种人类临床前模型包括细胞系(celllines)、患者源性的肿瘤异种移植(PDTX)和患者源性的肿瘤类器官(PDTO)。
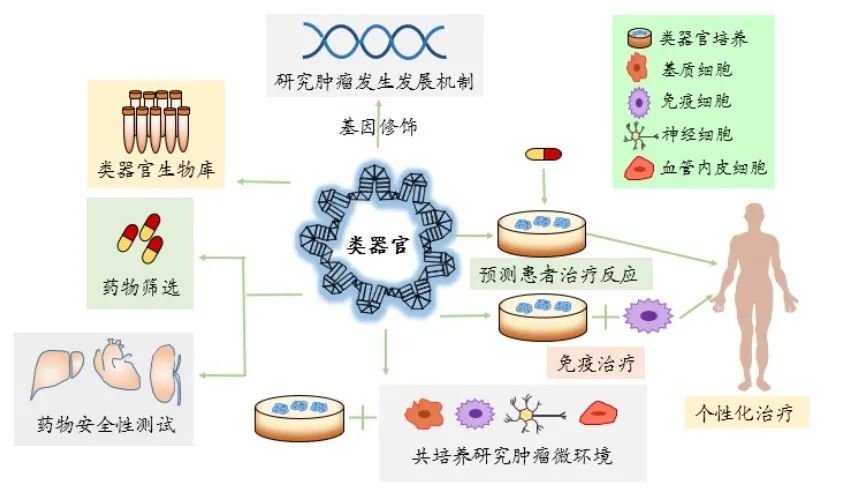
类器官的应用
1. 药物研究
由于肿瘤类器官是接近生理的结构,保留了母瘤的特定功能,并能准确地再现药物反应。因此,类器官技术填补了基于传统细胞系的药物筛选与临床试验之间的空白。研究表明,类器官可以作为评价癌症患者特异性反应的良好模型。此外,还可用来探索耐药性背后的详细因果和遗传改变。目前,一些癌症的类器官生物库已经建立,用于识别和测试新药物,而健康组织的类器官可以用于测试药物毒理学。

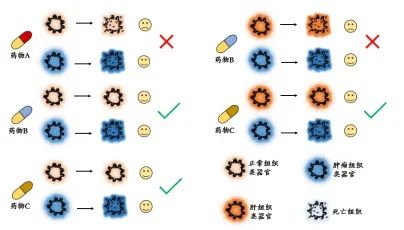
用类器官进行药物筛选

免疫治疗是一种新颖而有前景的肿瘤治疗策略,利用患者自身的免疫系统来杀死肿瘤细胞。免疫治疗的先决条件是恶性细胞表现出足够的免疫原性来触发足够的免疫反应。癌细胞的突变状态,有助于新抗原的产生,激活免疫反应。然而,由癌细胞新抗原引起的免疫反应强度不足,可以通过在体外激活和扩增免疫细胞,应用于患者体内来解决。多项研究为类器官技术在免疫治疗中的应用带来新的希望。如上皮内淋巴细胞在含有白介素-2、白介素-7和白介素-15的培养液中,与小鼠肠道类器官共培养,可维持增殖状态;有研究成功的进行T淋巴细胞与人原代乳腺上皮类器官的共培养,发现这些T淋巴细胞可以有效地清除三阴性乳腺癌的癌细胞。这表明,来自健康献血者的T淋巴细胞可以被类器官在体外扩大和激活,之后用于体内治疗患者,且可使健康献血者来源的T细胞对患者来源的类肿瘤细胞的细胞毒性效应在体外测试成为可能。将类器官与免疫细胞进行体外共培养,可以扩增免疫细胞,增强免疫反应,为后续的免疫治疗提供强而有力的保障。此外,研究肿瘤微环境也离不开类器官与免疫细胞及其他细胞的共培养技术。
综上所述,来源于人体不同组织的类器官,可用于药物的研究,有利于药物的筛选和新药的研发;也可对其进行基因编辑,来研究肿瘤的发生发展机制;还可在体外预测患者对临床治疗的反应,有利于为患者制定个性化的医疗方案。虽然类器官模型具有诸多优势但下述问题仍亟需解决:
1)提高生成效率,缩短类器官模型的培养周期,降低培养成本;
2)目前的类器官主要来源于上皮细胞,需要进一步研究非上皮类器官的培养方式;
3)目前暂无一个具有类器官的最优培养条件的标准化方案;
4)继续完善除免疫细胞和成纤维细胞之外的TME成分与类器官的共培养。
肿瘤是个复杂的疾病,无论发病机制、转移机制,还是患者对治疗的反应和耐药机制,均有很多尚未明确的问题亟需探索。未来的研究需要不断完善对TME的模拟,以创造更为接近原始肿瘤特性的肿瘤类器官模型,从而更为全面地了解恶性肿瘤。
来源:医世象
原文链接:http://mp.weixin.qq.com/s?__biz=MzU4NjUyNzYyOQ==&mid=2247506995&idx=1&sn=a346d21b18f9823af7b0eb5ed3d3b8c9
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

梁馨苓:急性肾损伤肾小管上皮细胞损伤机制新进展
肺上皮细胞通透性(LEP)测定
粪便上皮细胞

中年人要担心的不只是油腻,45岁起就该开始结直肠癌筛查
中国抗癌协会肿瘤护理专业委员会在津成立




Nature:正常结直肠上皮细胞体细胞突变图谱
肺上皮细胞通透性(LEP)测定

美研究说高剂量手机辐射可致大鼠心脏肿瘤
上皮细胞

苏洁博士等发现介导上皮细胞间质化的重要因子