科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-06
来源:BioArt
撰文 | 小飞飞
责编 | 兮
免疫治疗为肿瘤的治疗带来了革命性的改变。但是目前这些免疫调控的方式主要聚焦于提高T细胞免疫反应,要么通过免疫检查点抑制剂(immune checkpoint inhibitor)靶向抑制性通路,要么利用嵌合抗原受体T细胞(chimeric antigen receptor T cells)靶向激活通路,或者利用双特异性抗体等。虽然这些治疗取得了一定的成功,但只有部分病人对治疗有反应,急需寻找能应用在下一代免疫治疗的新的细胞和分子靶标。T细胞反应的起始维持以及长久保护性记忆T细胞反应都依赖于固有免疫反应(图1)。固有免疫细胞,如树突状细胞可以将肿瘤抗原交叉提呈给CD8 T细胞,从而激活肿瘤特异性CD8 T细胞,使其发挥效应功能从而杀伤肿瘤细胞。同时固有免疫系统NK细胞也可发挥效应作用而杀伤肿瘤细胞。考虑到固有免疫系统在机体中的重要作用,固有免疫反应对的适应性免疫反应的起始以及调控作用,利用这些固有免疫反应,或可取得更持久的多层次的肿瘤治疗与控制。
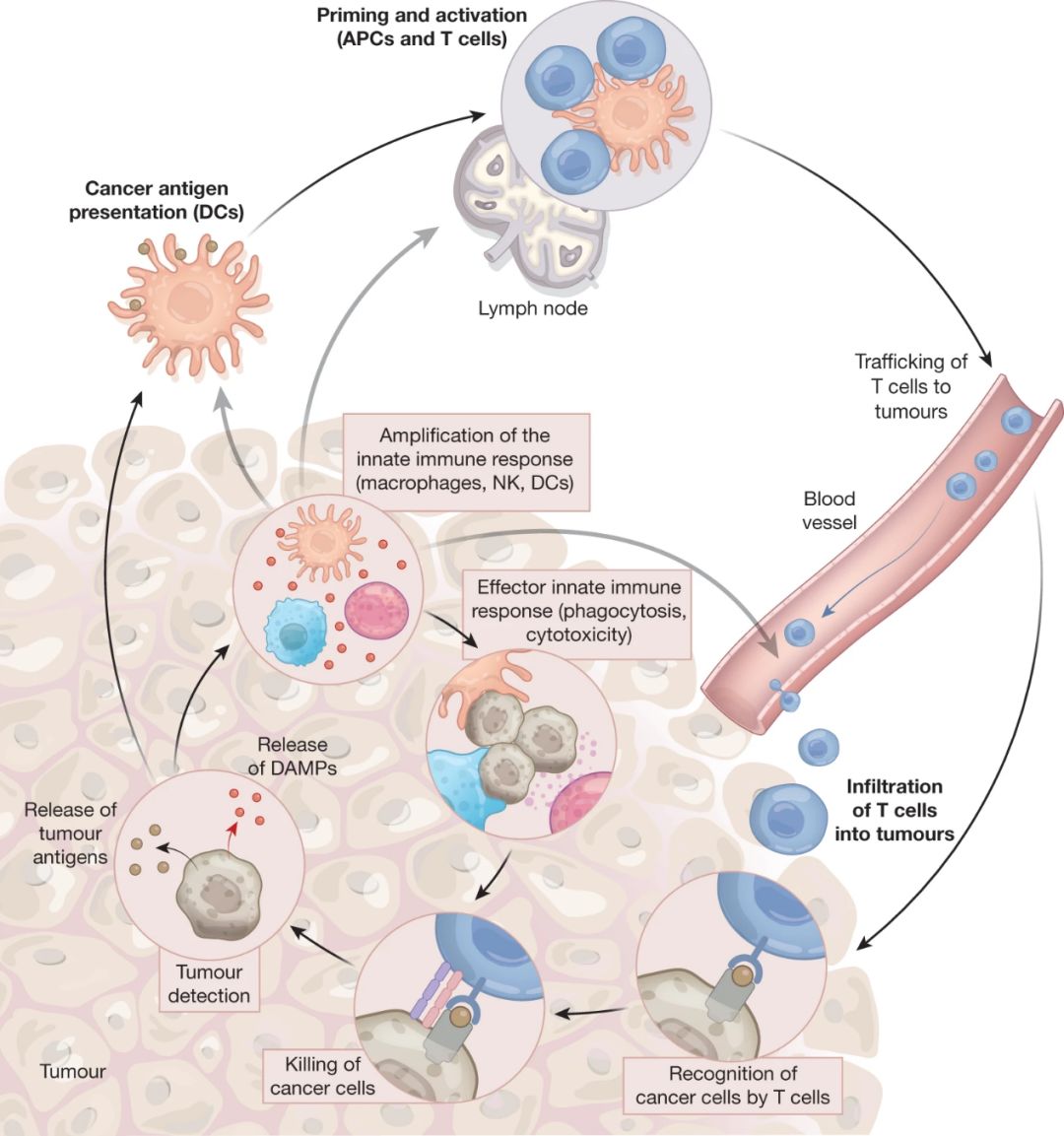
图1 免疫细胞和肿瘤细胞相互作用,固有免疫细胞也在其中起重要作用。
不久前,来自法国Aix Marseille Université的Eric Vivie教授团队在Nature发表题为Harnessing innate immunity in cancer therapy的综述文章,系统阐述了固有免疫反应在抗肿瘤免疫反应以及免疫治疗中的作用。

该综述主要分四个方面:固有免疫细胞如何识别肿瘤;诱导并增强适应性免疫反应;直接行使效应功能;以及在肿瘤微环境中,这些效应被抑制的机制。许多研究和试验都在尝试操纵固有免疫反应过程来抗肿瘤,本综述还 讨论那些有比较好的临床前数据和在早期临床试验有不错效果的分子(总结如表1)。
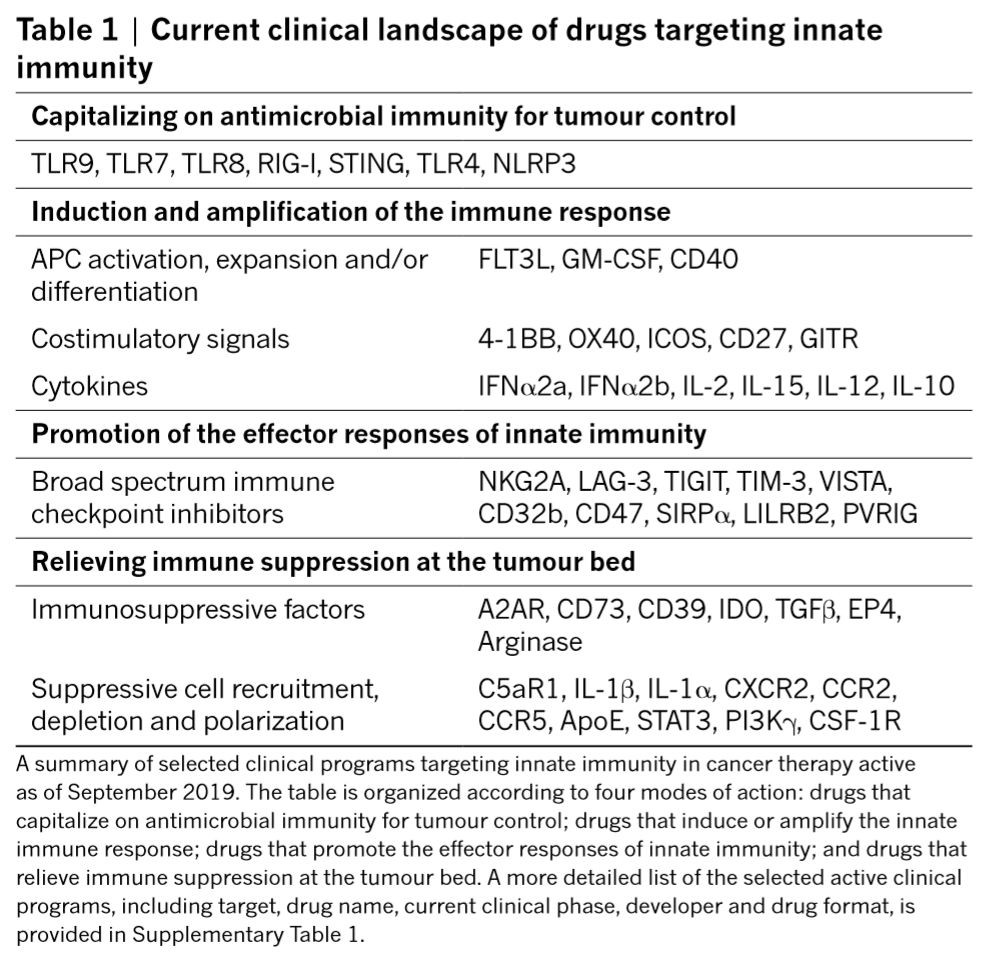
表1 目前肿瘤免疫治疗中靶标的固有免疫分子
第一部分:固有免疫细胞对肿瘤的识别(Tumour recognition by innate immune cells)
肿瘤细胞具有较高的异质性,尽管一些体细胞DNA的突变能将正常细胞转化为恶性细胞,但我们一直并未找到在所有肿瘤中共存的分子通路,也没有证据表明肿瘤细胞表达有共同的决定因子或模式分子可被免疫系统识别。虽然免疫细胞能识别几种和不同肿瘤相关的一些改变,但这些改变也并不是肿瘤所特有的,例如细胞代谢,组织代谢或者组织损伤也可能在非肿瘤的情况下发生。治疗性操纵这些免疫识别通路,为提高免疫系统对肿瘤的控制提供新的可能性。
1.1 抗微生物免疫
体内识别发现病毒和细菌感染的免疫通路也可参与到对肿瘤细胞的识别中。据目前所知,机体对肿瘤细胞的识别并没有特异性的机制。相反,机体也利用病原和损伤受体识别肿瘤。对核酸的识别就是一个很好的例子,机体利用识别感染的通路来识别生长中的肿瘤的从而产生肿瘤特异性的免疫反应。核酸识别包括内体TLR受体,STING分子和RIG-I样受体等。人工合成的模拟感染诱导分子,可以在肿瘤中引起“病原诱导样”固有免疫反应来达到治疗目的。瘤内注射这些免疫刺激分子可以提高他们的生物利用度且减少系统性用药的毒性。与疫苗和CAR T细胞相比,这种方法利用了肿瘤中存在内源性的抗体库而不需要利用某种特定的肿瘤抗原。在临床前的模型中,以TLRs,STING和RLRs为靶标的人工合成分子,可以有效减少注射部位肿瘤的大小。这种抗肿瘤活性是由多过程介导的,包括直接诱导肿瘤细胞死亡,促进I型干扰素,促炎细胞因子和招募T细胞的趋化因子的产生,NK细胞的细胞毒性作用,吞噬作用,DC的成熟以及对肿瘤特异性CD8 T细胞的促进,因此产生长期系统的保护作用。免疫检查点阻断治疗和调节性T细胞的删除可进一步提高肿瘤内激活剂的效率。TLR9,STING,RIG-I激动剂在一些探索性的临床试验中都有一定的效果,但这些试验病人数目有限,还需要进一步的临床研究来验证这些固有免疫识别通路的抗肿瘤效应。
1.2 压力应激反应
化疗和放疗能够通过免疫原性细胞死亡(immunogenic cell death,ICD)赋予肿瘤细胞免疫原性,提高机体对肿瘤细胞的识别。有研究表明,濒临死亡的肿瘤有一些损伤相关分子模式(damage-associated molecular patterns,DAMPs)特征可以诱发一系列的免疫反应。这些DAMPs分子包括“eat me”信号,比如细胞表面暴露的钙网蛋白(calreticulin),蛋白二硫键异构酶家族成员3(PDIA3),以及热休克蛋白HSP70和HSP90,可以提高抗原呈递细胞对肿瘤细胞和细胞碎片的摄取。ICD也可以诱导免疫刺激因子的产生,如ATP,IL-1β,I型干扰素,CXCL10,HMGB1等。这些分子可以调控肿瘤微环境中固有免疫和适应性免疫细胞的组成和功能。体外研究实验表明,多种类型的抗肿瘤治疗能够上调肿瘤细胞的压力诱导分子,使肿瘤细胞更容易被NK细胞杀伤。临床上,化疗和/或靶向治疗和免疫检查点阻断治疗联合,已经在某些肿瘤治疗中被用于一线治疗,如肺癌和恶性肾细胞癌。免疫检查点阻断治疗在乳腺肿瘤中的效果很差,但一项III期临床试验结果显示,免疫治疗和标准化疗的联合疗法能够提高转移性三阴性乳腺癌病人的无进展生存。与之类似,放疗也可以诱导ICD标志分子,也可诱导肿瘤DNA的释放,激活固有免疫细胞STING信号通路。
第二部分:诱导增强免疫反应
固有免疫在促进T细胞效应功能方面有重要作用,许多治疗方法靶向增强这一效应(图1,表1)。大多数方法还有待临床试验验证,但对于一些细胞因子的临床前研究已经产生了一些有意思的结果,例如FLT3L,GM-CSF, I型干扰素,IL-2和IL-15,可以诱导抗原呈递细胞的增殖成熟或NK细胞的活化。
FLT3L能够促进造血前体细胞向树突状细胞发育,并促进树突状细胞的存活和增殖。小鼠体内注射FLT3L可以促进交叉提呈树突状细胞亚群的扩增,增加了肿瘤内浸润的抗原特异性的CD8T细胞数目,提高了对瘤内注射TLR3激动剂的反应性。在病人临床试验中,一项瘤内疫苗将FLT3L和TLR3激动剂联合,并结合局部放疗,结果表明,该项治疗可以提高交叉提呈树突细胞在肿瘤部位的数目和活化,提高了肿瘤特异性CD8T细胞激活,提高了对免疫检查点阻断治疗的效率。GM-CSF在树突状细胞的分化和招募中也具有重要作用。GM-CSF可通过招募NK细胞和包括树突状细胞在内的髓系细胞,促进对肿瘤抗原的提呈,来达到抗肿瘤的作用。小鼠肿瘤部位注射GM-CSF可以刺激免疫系统,在小鼠体内产生持久的抗肿瘤免疫反应。病人体内肿瘤内注射GM-CSF也可以提高肿瘤内浸润的树突状细胞。GM-CSF现在应用于多种肿瘤疫苗的设计配方中,并有一定的临床效果。但目前还不知道,这两种方式对抗原呈递细胞数目和活性的提高,是否会产生肿瘤新抗原特异性T细胞还是扩增已经存在的肿瘤特异性T细胞库。
I型干扰素对固有免疫细胞具有多种作用(图2)。I型干扰素能促进抗原呈递细胞交叉提呈,增强抗原呈递细胞对死细胞相关抗原的提呈和向引流淋巴结的迁移。I型干扰素可以提高瘤内注射TLR7,TLR9,STING激动剂对PD-1阻断治疗的反应性。I型干扰素也能通过促进CXCL9和CXCL10的产生吸引NK细胞到肿瘤部位。未修饰或者聚乙二醇化的IFNα2a和IFNα2b已经被用于多种肿瘤的治疗。但由于毒性和对总体生存率影响不确定而并未广泛应用。基于抗体-细胞因子联合策略,可以将I型干扰素定向输送到肿瘤部位,已经有不错的临床前数据。
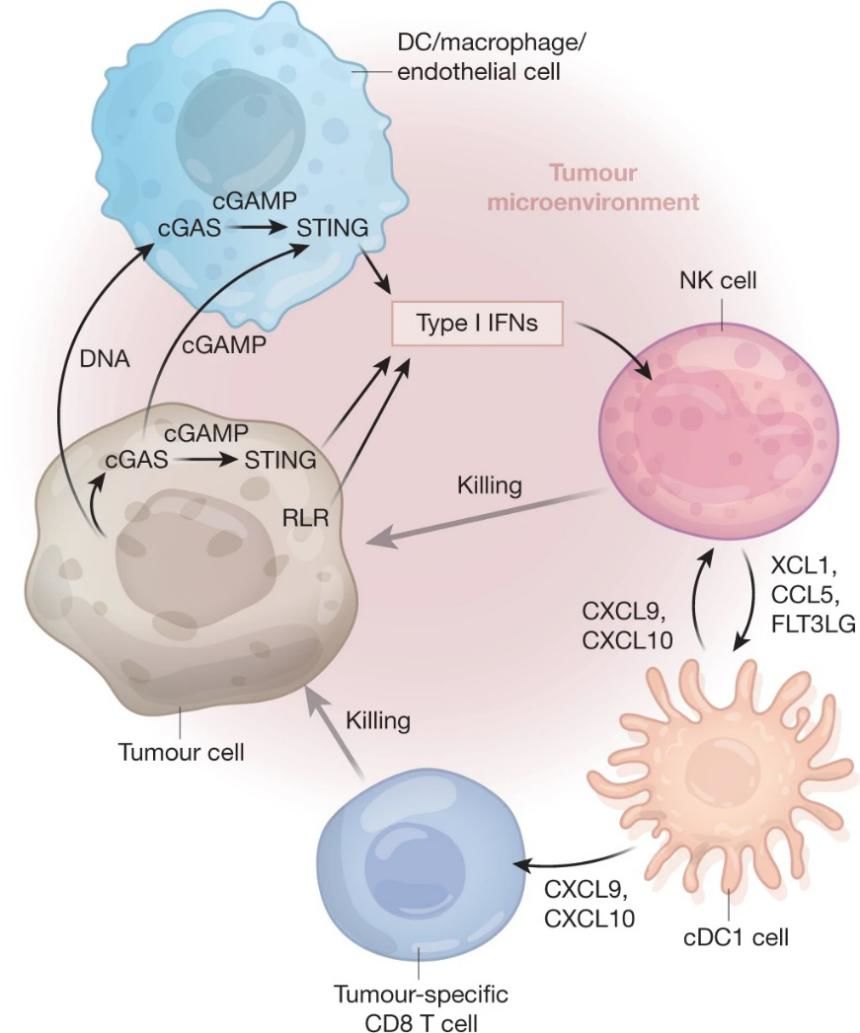
图2 I型干扰素在固有免疫和T细胞介导的抗肿瘤免疫中的桥梁作用
IL-2可以诱导T细胞的活化和增殖,促进效应和记忆T细胞的产生,IL-2也能刺激NK细胞核ILC2s。但IL-2也可以促进Treg细胞亚群的增殖,IL-2过短的半衰期,高剂量利用时有较大的毒性,这些都限制了IL-2的广泛应用。对IL-2进行改造以克服其缺点的临床试验正在进行。IL-15和IL-2类似,也可以促进CD8 T细胞,NK细胞,γδ T细胞和自然杀伤T细胞的活化和扩增。
第三部分:固有免疫的效应作用(The effector responses of innate immunity)
除了对T细胞活性的促进作用,固有免疫细胞也能像T细胞类似,有一定直接的抗肿瘤效应功能,可通过靶标活化受体或阻段抑制性通路来操纵固有免疫细胞的效应作用。
3.1 Fc受体
抗肿瘤抗体和FcRs的结合使许多缺少抗原受体的固有免疫细胞可以特异性作用于肿瘤细胞。因此,抗肿瘤抗原的治疗性抗体可以激活细胞毒性细胞(如,NK细胞)和/或吞噬细胞(如,单核细胞和巨噬细胞)上的活性Fc受体来消灭肿瘤细胞。大多数肿瘤靶向的治疗性抗体是人IgG1抗体,可以和FcγRs结合。活性FcγRs受体包括FcγRIIA,FcγRIIC,FcγRIIIA和FcγRI。这些FcγRs有不同的组织分布,因此有不同的生物学效应。细胞类型,FcγRs类型以及机制的不同,会导致最后抗体的效应作用不同。抗CD20的单克隆抗体rituximab,可以通过单核细胞和巨噬细胞上有ITAM的活性FcγRs,来消灭恶性B淋巴细胞瘤,用于治疗非霍奇金淋巴瘤和慢性B淋巴细胞白血病。人们也不断改造新一代的单克隆抗体,提高抗体和不同类型活性FcγRs的结合,相应的临床试验也正在进行。但是需要注意的是抑制性FcγRs的存在,也使得抗体-FcγRs介导的抗肿瘤效应变成促肿瘤效应。
3.2 广谱的免疫检查点抑制剂
除了T细胞,靶向NK细胞和/或髓系细胞的广谱的免疫检查点抑制剂也被发展起来。这种新型治疗方式基于两个概念:释放更多的T细胞刹车器,重新恢复固有免疫和T细胞的功能。
NKG2A是NK细胞和T细胞上抑制性的受体,识别HLA-E。和MHC-I不一样,HLA-E在肿瘤细胞中正常表达或高表达。Monalizumab是抗NKG2A的IgG4-阻断型单克隆抗体,在和抗PD-1抗体联用可以提高效应T细胞的反应,且还可以提高NK细胞的效应功能和ADCC。Monalizumab是能同时恢复NK细胞核T细胞功能的免疫检查点抑制剂的代表性例子。许多相应的临床试验也正在进行。
TIGIT是在NK细胞和T细胞亚群上有表达的一个抑制性受体。TIGIT可以和抗原呈递细胞,T细胞和包括肿瘤在内的非造血细胞上的CD155和CD112相互作用,来下调免疫作用。TIGIT缺失小鼠体内肿瘤生长明显减缓。临床试验表明黑色素瘤病人中,在CD8T细胞上同时阻断TIGIT和PD-1,可以提高抗肿瘤疗效。
TIM-3在T细胞,NK细胞,NKT细胞和树突状细胞上表达。TIM-3可以识别几个不同的配体,galectin-9, HMGB1, CEACAM1和凋亡细胞表面表达的磷脂酰丝氨酸。TIM3是一个调节T细胞和NK细胞功能的抑制性受体,和T细胞NK细胞的衰竭以及Treg和肿瘤相关巨噬细胞的免疫抑制功能相关。TIM-3也能够通过抑制树突状细胞对肿瘤核酸的识别。通过这些多种不同的机制,TIM-3抑制抗肿瘤免疫反应并促进肿瘤耐受。在临床前的模型中,TIM-3单克隆抗体都有不错的疗效。靶向TIM-3的相关临床试验也正在进行中。
淋巴细胞激活基3(Lymphocyte activation gene,LAG-3)是一个抑制T细胞激活和细胞因子分泌的抑制性受体。LAG-3通过识别肿瘤细胞以及肿瘤微环境中存在的几种分子来抑制细胞功能,MHC-II, galectin-3,LSECtin和FGL1。LAG-3在CD4 T细胞上表达,Treg细胞,CD8肿瘤浸润淋巴细胞,B细胞,NK细胞,NKT细胞和浆细胞样树突状细胞上也都有表达,可下调这些细胞的功能。临床试验也发现LAG-3的却是一个很有潜力的新的免疫检查点。靶向LAG-3的临床试验有不错的初步结果。
信号调节蛋白(Signal-regulatory protein-α,SIRPα)是一个含有ITIM的抑制性受体,在巨噬细胞,树突状细胞,肥大细胞和中性粒细胞等髓系细胞上表达。SIRPα识别CD47,CD47常常在肿瘤细胞上表达。CD47和SIRPα的相互作用可以使肿瘤细胞逃避吞噬作用,通过抗CD47抗体抑制CD47-SIRPα相互作用,可提高巨噬细胞对肿瘤细胞的吞噬。抗CD47抗体也能和诱导ADCC的治疗性抗体协同作用,促进肿瘤细胞的消除。一项在实体瘤和淋巴瘤病人中的抗CD47的I期临床试验展现出很安全的毒性范围以及一定的效应反应。其他联合用药的治疗试验也正在进行。
第四部分:解除肿瘤环境中的免疫抑制
肿瘤中的免疫抑制微环境可导致病人对免疫检查点阻断治疗的不响应。肿瘤细胞产生的免疫抑制因子能直接改变T细胞的效应功能,同时也能够抑制固有免疫细胞的功能,阻止它们维持有效的抗肿瘤免疫反应。例如,髓系细胞,比如髓系来源抑制细胞(myeloid-derived suppressor cells,MDSCs)或者肿瘤相关巨噬细胞(tumour-associated macrophages,TAMs)向肿瘤部位的侵袭,帮助肿瘤细胞产生了一个耐受环境抑制抗肿瘤免疫活性。从人肿瘤中分离的TAMs或MDSCs也有免疫抑制作用;在多种肿瘤病人中,高水平的循环MDSCs和肿瘤浸润MDSCs或者TAMs和较差的预后相关。多种通路可以通过直接的抑制效应细胞的功能或促进抑制性细胞的扩增,浸润和活化来发挥免疫抑制功能。许多靶向这些通路的临床试验正在进行。
多种肿瘤中腺苷合成通路活性的增加和较差的预后相关。腺苷在肿瘤微环境中的缺氧部位由产生,ATP被CD39降解为ADP和AMP,然后AMP被CD73去磷酸化产生腺苷。腺苷和腺苷受体A2AR和A2BR相互作用可以降低NK细胞和CD8T细胞的增殖和效应功能。此外,肿瘤微环境中髓系细胞上的A2AR和A2BR信号通路,可以帮助建立免疫抑制的环境,还可通过增加抑制性细胞因子IL-10的表达,控制肿瘤中T细胞和NK细胞的数量和活性。小鼠中CD39和CD73的缺失,去除了腺苷的合成,可以诱导抗肿瘤反应。几项靶向腺苷合成通路的临床试验也正在进行。
转化生长因子(Transforming growth factor-β,TGFβ)对多种细胞都具有多种活性,对癌症也有双重的效应,既可以作为一个肿瘤抑制因子也可以作为一个肿瘤促进因子。TGFβ能够直接抑制CD8T细胞的细胞毒性作用,刺激Treg细胞的产生。TGFβ也能够抑制固有免疫系统,通过抑制mTOR通路降低NK细胞的增殖和细胞毒性作用,它也能够将具有较强抗肿瘤作用的NK细胞转化为功能较低的ILC1亚群。TGFβ影响髓系细胞,作用于肿瘤浸润巨噬细胞和中性粒细胞,提高它们对肿瘤的抑制效应。TGFβ也能影响树突状细胞的活化,降低树突状细胞将抗原交叉提呈给CD8T细胞的能力。许多TGFβ通路的抑制剂正在研究中,但是TGFβ在肿瘤中的双重作用,多种活性,以及TGFβ1,TGFβ2和TGFβ3的生物学差异,都使得靶向这一靶点颇具挑战性。多种抑制TGFβ通路的临床试验也正在进行。
其他在肿瘤中起免疫抑制作用的分子包括COX2,C5a,CSF-1,IL-1等;COX-2-PGE2通路可以抑制树突状细胞的成熟和T细胞和NK细胞的活化和成熟,提高了M2型抑制性巨噬细胞以及Treg的分化。补体系统中的C5a,可以和髓系细胞上的C5aR1受体相互作用,肿瘤微环境中的C5a招募髓系抑制性细胞,从而抑制CD8T细胞的抗肿瘤活性从而抑制肿瘤生长。CSF-1和CSF-1R相互作用可以能够促进髓系细胞向M2巨噬细胞和抑制性的MDSCs分化,从而起到肿瘤抑制作用。IL-1α和IL-1β在肿瘤微环境中产生促进肿瘤发生,侵袭转移的炎症微环境,同时还能够招募抑制性的髓系细胞如MDSCs或者TAMs。靶向这些通路,都能产生一定的抗肿瘤效应,相关的临床试验也正在进行。
展望:下一代免疫治疗
除了免疫检查点抑制剂和肿瘤疫苗在肿瘤治疗中的重要作用,CAR T细胞疗法也取得了不错的效果,尤其是在治疗血液性肿瘤中,但CAR T细胞疗法由于其毒性和在实体瘤中有限的作用而受到使用上的限制。研究CAR non-T细胞的研究也正在进行,几项CAR NK细胞的临床试验也在进行,CAR 巨噬细胞也已经被产生出来了,能使单核巨噬细胞向抗肿瘤的M1型分化。
由不同单克隆抗体片段组装而成的多功能分子也正成为未来免疫治疗肿瘤的有力手段。和作用于T细胞的双特异性T细胞抗体(bispecific T-cell engagers,BiTEs)类似,作用于CD16的BiKEs(bispecific killer cell engagers)以及作用于CD16和IL-15的TriKEs(trispecific killer cell engagers)都被设计出来靶向实体瘤上的特定抗原,来招募杀伤性细胞,进而实现肿瘤细胞的清除。BiKEs和TriKEs在体外和临床前实验中都有不错的作用。作用于NK细胞上NKp46 和CD16以及靶向肿瘤特异性抗原的三功能NK细胞抗体(Trifunctional NK cell engagers,NKCEs)也被设计出来,并且在临床前研究中有较好的效果。
肿瘤细胞上的糖基化改变已经被发现数十年了,但是靶向糖基化的治疗策略却少有进展。唾液酸化修饰Sialylation是其中一种修饰,Siglecs家族蛋白和唾液酸结合,髓系细胞上不同Siglecs的表达,对机体抗肿瘤免疫起不同作用,靶向Siglecs家族或可成为新的肿瘤治疗靶点。
尽管我们已经做了很多尝试来利用固有免疫,维持并提高肿瘤特异性T效应细胞的数量和功能。但是,我们仍然不知道,这些方法是否诱导产生了新抗原特异性的T细胞。理论上来讲,未来能扩大T细胞对肿瘤抗原库识别的疗法将会极大提高当今免疫疗法的效果。
最后,未来的研究还需要解决一些我们关于抗肿瘤免疫上的概念性的缺失。我们目前并不知道任何特异性的肿瘤识别机制,那么是什么因素决定了肿瘤-免疫相互作用的结果?还有为什么细胞死亡诱导的炎症在一些情况下导致组织修复反应从而促进肿瘤发展,然而在其他情况下,却可以诱导T细胞的激活和抗肿瘤反应?这种结果是取决于组织来源,突变或者还是现在没有发现的肿瘤微环境中的因素?肿瘤免疫中仍有许多基本问题值得研究。
值得一提的是,在前不久10月23日北京举行的第17届国际免疫学大会上,Eric Vivie教授就以Targeting innate immunity in cancer immunotherapy为题做了专题讲演,以NK细胞在肿瘤免疫中的作用为例,阐述了固有免疫系统在肿瘤免疫中的重要价值。
原文链接:
https://www.nature.com/articles/s41586-019-1593-5
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479671&idx=1&sn=3f1f4fbef6bbb44da6090d196c66332b&chksm=84e23303b395ba155abe4961477138042ec2e8228b9f1d74d8513fba77f4d4d4fbc61ff71909&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
科研人员发现新免疫抑制细胞影响抗肿瘤免疫应答
细胞膜包裹的纳米药物用于免疫抑制微环境的调控及无免疫原性肿瘤的治疗
科学家用灵芝当妙药 “饿死”肿瘤细胞

蝙蝠通过免疫抑制毒素促进病毒传播

胶质母细胞瘤中PD-L1介导的免疫抑制与肿瘤相关巨噬细胞的浸润和M2极化相关
美揭示脑癌细胞长寿关键秘密
诺奖解读:免疫抑制获奖 为啥没有这位中国科学家



靶向基因变异精准“击退”白血病
“蛋结构”材料能有效杀伤肿瘤细胞

深圳先进院肿瘤免疫抑制研究获进展