科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-06
来源:CBG资讯
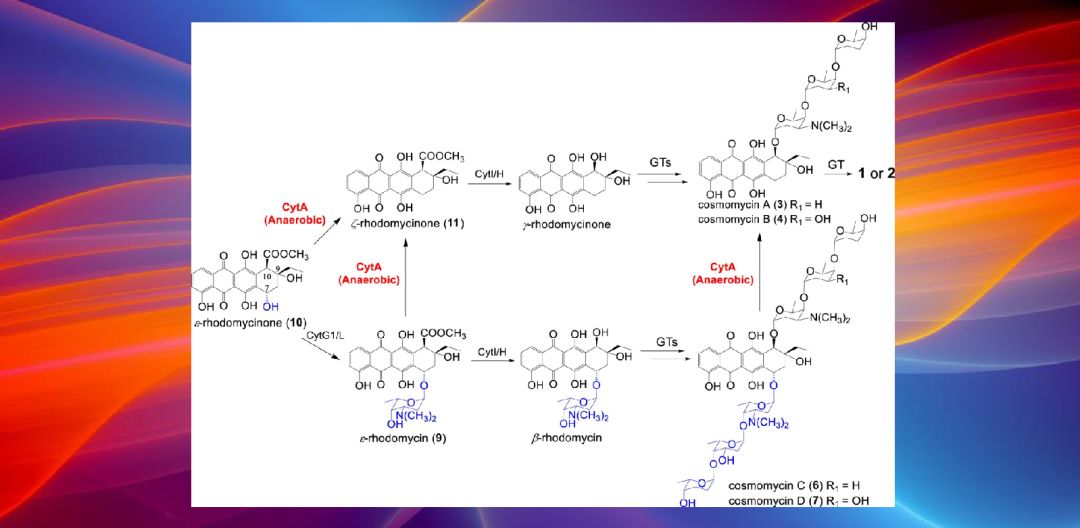
中国科学院南海海洋研究所鞠建华研究员课题组,通过开展生物合成途径的解析、体内外生化实验表征及生物活性检测等系列研究,揭示了海洋链霉菌产蒽环类抗生素自我解毒的抗性机制,论文以“CytA, a reductase in the cytorhodin biosynthesis pathway, inactivates anthracycline drugs in Streptomyces”为题发表于Communications Biology(DOI: 10.1038/s42003-019-0699-5)。
微生物可生产结构多样的活性次级代谢产物作为化学防御分子,但杀伤力过大的“武器”,总会引起“杀敌一千,自损八百”的不良效应。因此,微生物进化出了多种自我解毒机制,包括:利用外排泵将体内积累的毒性代谢物排出,通过化学修饰降低毒性,以无/低活性前体的形式储存在体内,毒性物质在体内的区域化隔离以及产生抗性蛋白用以自我保护等。
研究人员揭示了一类未知功能蛋白CytA,该蛋白还原性消除蒽环类抗生素C-7位糖基链使之失活,从而赋予该菌株自抗性的功能。该研究中所报道的Streptomyces sp. SCSIO 1666为来自海洋的放线菌,生存于与陆地迥异的生态环境使其能够产生一系列抗菌和细胞毒活性天然产物。通过生物合成基因簇异源表达结合生物信息学分析,作者推测并佐证了由CytA基因编码的还原酶催化C-7还原反应。体内CytA基因敲除实验发现CytA突变株可积累7位含糖链的4个中间体化合物,对这些中间体进行活性测试,作者推测了CytA发挥逐步解毒的作用和步骤,值得一提的是,CytA的催化还原还是一个严格厌氧的过程。在CytA的体外催化实验中,作者选取了多个临床应用的蒽环类抗肿瘤药物,发现其均可被CytA转化为各自的C-7还原脱糖基的低毒产物,表明CytA具有一定的底物宽泛性。
系统发育树分析结果表明,CytA所属的还原酶家族广泛分布于细菌、古菌和真菌中,而且大多数同源蛋白的功能均未表征。作者团队的研究结果表明CytA及其同源蛋白很可能是蒽环类抗生素生产菌株自我解毒的新手段。由此,CytA基因可作为基因标签用以挖掘更多的蒽环类抗生素,为临床药物筛选提供化学实体。
博士生桂春为论文第一作者。该研究工作得到国家杰出青年科学基金、中科院战略先导海洋科技专项和广东省自然科学基金团队项目的资助。
原文(扫描或长按二维码,识别后直达原文页面):

来源:BeanGoNews CBG资讯
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247498416&idx=3&sn=134c3fef6acfb78362190a8c766edcee&chksm=ec3cfbf9db4b72efa9c9ee63fb2dada5964cac0f7fba021345223efae03bc50bfc093e21b9f6#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn