shaolyn
加好友
shaolyn 2021-09-09
自从植物存在免疫系统这一现象被两位科学家(Jeffery Lee Dangl和Jonathan Dallas George Jones)确定以来,植物免疫学这一学科蓬勃发展,植物免疫领域涌现出了一系列重要成果。长期以来,大多数植物免疫领域的研究都是将PTI (Pattern-Triggered Immunity) 和ETI (Effector-Triggered Immunity) 两条免疫通路作为两个独立平行的免疫分支,但随着研究的广泛和深入,以PTI和ETI为基础的两条主线从泾渭分明变得交叉模糊,但这两层免疫系统之间的具体关系一直以来尚不清楚,这也成为了植物免疫领域尚待解决的重要科学问题之一。
2021年3月,Nature背靠背发表了两项研究成果,分别为中国科学院分子植物科学卓越创新中心辛秀芳团队完成的题为Pattern-recognition receptors are required for NLR-mediated plant immunity的论文和英国塞恩斯伯里实验室(The Sainsbury Laboratory)Jonathan Jone团队完成的题为Mutual potentiation of plant immunity by cell-surface and intracellular receptors的论文。两项成果揭示了植物两大类免疫通路PTI和ETI并不是独立发挥功能,而是存在相互放大的协同作用,从而保障植物在应对病原菌的入侵时能够输出持久且强烈的免疫响应。
时隔半年,2021年9月8日,德国University of Tübingen的Thorsten Nürnberger研究组和Max Planck Institute for Plant Breeding Research的Jane Parker研究组在Nature发表了题为The EDS1–PAD4–ADR1 node mediates Arabidopsis pattern-triggered immunity的研究论文,揭示了EDS1–PAD4–ADR1模块同时参与膜定位和胞内LRR受体相互作用从而参与激活植物ETI和PTI的作用机制。

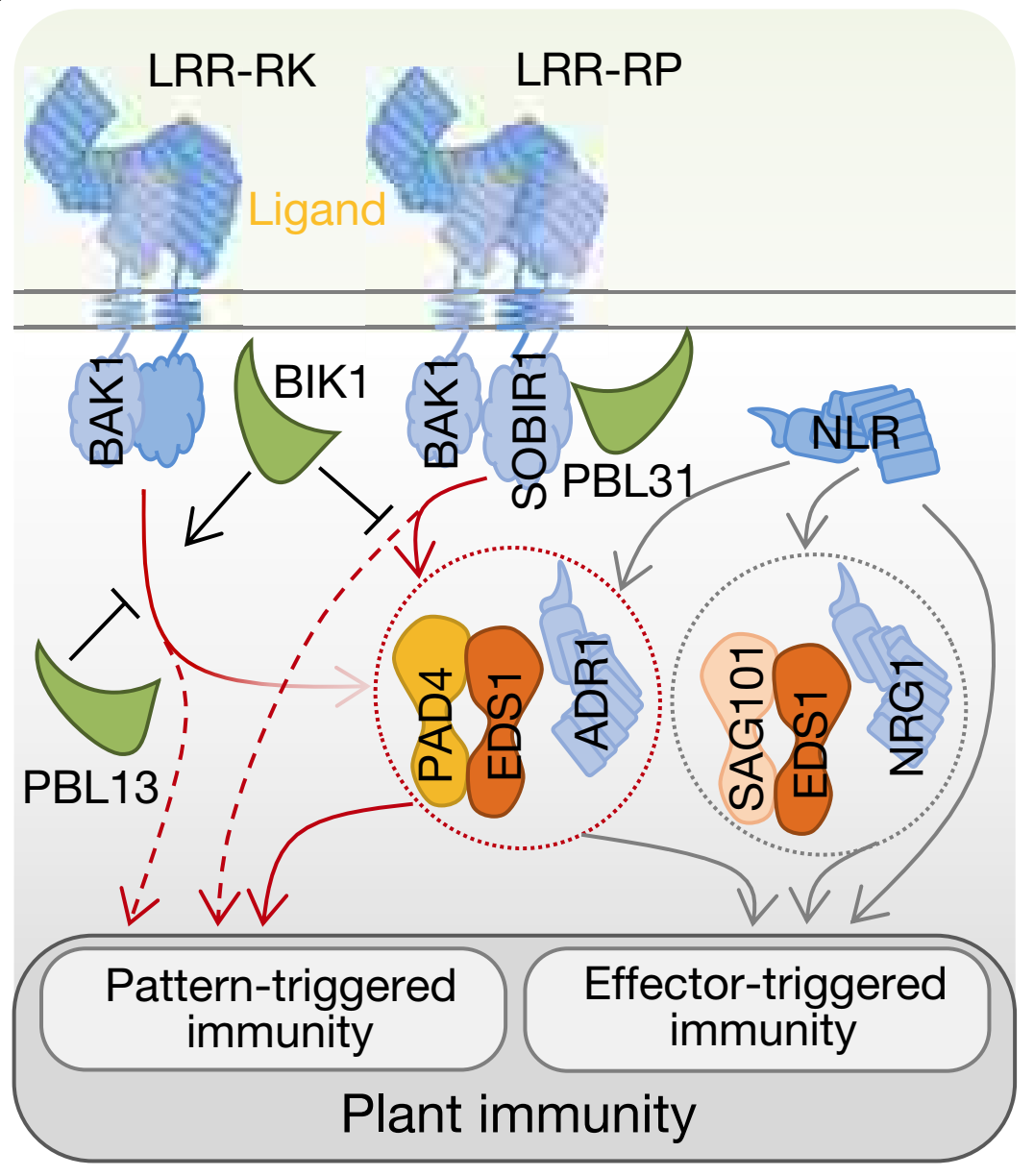
植物在与病原菌长期“博弈”的过程中,进化出了PTI和ETI两层免疫系统。通常,质膜定位的LRR(leucine rich-repeat domain)受体激酶(LRR-RKS)和LRR受体蛋白(LRR-RP)–SOBIR1复合体会通过类受体胞质激酶(RLCKs)及其下游免疫反应激发PTI免疫【1】。同时,胞内核苷酸结合LRR(NLR)受体通过ADR1家族和NRG1家族的 helper NLRs(hNLRs)与EDS1、SAG101以及PAD4等类脂肪酶蛋白协同诱导ETI免疫【2】。
之前研究表明,RLCK第七亚组(RLCK-VII)成员BIK1正调控在LRR-RK介导的PTI,但是负调控LRR-RP介导的PTI响应【3】。为鉴定介导LRR-RP型PTI的正调节因子,该研究首先进行了DNA文库筛选,发现pbl31突变体丧失了对LRR-RP激发子的免疫响应,并且PBL31和PBL30及PBL32共同隶属于RLCK第七亚组。此外,LRR-RP激发子诱导的乙烯产生在pbl30 pbl31 及pbl30pbl31pbl32突变体中显著降低,而LRR-RK激发子诱导的乙烯产生也受到部分抑制。同样,LRR受体蛋白介导的免疫反应,如活性氧产生、胼胝质形成及植保素合成相关基因的表达在pbl30pbl31pbl32突变体中显著抑制,但是LRR-RK激发子诱导的免疫响应并未受到显著影响。有趣的是,pbl30pbl31pbl32突变体中的ETI响应并未受到影响。上述研究表明PBL30和PBL31对LRR-RP型PTI的激活是必需的,而在LRR-RK型PTI中发挥较少作用,并且对ETI免疫响应是非必要的。
此外,EDS1可以与SAG101或PAD4形成二聚体并在ETI中控制不同的免疫分支,其中EDS1-PAD4二聚体不仅可以诱导ETI免疫,还可以促进植物的基础免疫【4】,但是尚不清楚该二聚体是否在PTI诱导中发挥功能。该研究发现,LRR-RP激发子诱导的乙烯产生在psd4和eds1突变体中显著降低,而LRR-RKs激发子介导的乙烯产生并未受到影响。此外,不能与PAD4形成二聚体的EDS1变体不能恢复LRR-RP介导的乙烯响应,并且EDS1–PAD4二聚体的信号表面阳离子残基突变(EDS1R493A)在抑制ETI的同时,也抑制了LRR-RP介导的乙烯生产。类似的,pad4和eds1突变体中LRR-RP(而非LRR-RK)激发子诱导的活性氧产生、胼胝质积累及植保素基因表达受到抑制,但是LRR-RKs相关响应并无显著变化。以上表明EDS1–PAD4信号复合体在NLR介导的EIT及LRR-RP介导的PTI中发挥重要作用,而在LRR-RK介导的PTI响应中仅发挥部分功能。
通常,EDS1–SAG101二聚体与NRG1家族hNLRs共同作用调节TIR-NLR ETI信号,而EDS1–PAD4二聚体则与ADR1家族hNLRs共同激活ETI及基础免疫【5】。该研究发现,LRR-RP激发子诱导的免疫响应在ADR1家族hNLRs(而非NRG1家族)突变体中被显著抑制,并且‘helperless’(ADR1家族基因及两个NRG1基因缺失)突变体与adr1突变体表型一致,这再次表明LRR-RP响应需要PAD4而非SAG101。然而,两种突变体对LRR-RP和LRR-RK激发子诱导的免疫能力均显著降低。上述结果表明,EDS1–PAD4–ADR1在细胞膜PTI和胞内ETI信号中均发挥功能。
在此基础上,研究人员测定了共受体SOBIR1在该免疫调节模块中的功能,发现RLP23及SOBIR1均与PBL31存在相互作用。此外,SOBIR1以独立于配体的方式与PAD4,EDS1,ADR1及其亚型ADR1-L1和 ADR1-L2相互作用,而双分子荧光互补和荧光素酶互补试验结果则表明SOBIR1与ADR1-L1具有相互作用。进一步通过蛋白互作验证,该研究表明膜定位的LRR-RP–SOBIR1受体会与PBL31形成复合体并与EDS1-PAD4-ADR1模块共同介导PTI响应,这同时也暗示了含有PTI受体的超分子复合物可以存在于质膜内侧。该研究还发现,拟南芥中LRR-RP和NLR基因在序列多样性上具有相似的进化动力学,而LRR-RK编码基因的多样性较低,这同时解释了了LRR-RP与LRR-RK在植物免疫诱导中发挥不同作用的原因。
The EDS1–PAD4–ADR1 node mediates both PTI and ETI
综上所述,该研究发现EDS1–PAD4–ADR1模块可以同时在胞膜及胞内LRR受体激活的防御信号级联中发挥作用,并通过PTI和ETI共同调节植物免疫。该研究结果是继Nature背靠背发文揭示植物PTI与ETI具有协同免疫作用后的又一突破。
来源:BioArt植物
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3ODY3MDM0NA==&mid=2247510510&idx=1&sn=1629b5eda8b900310a9df6a6fd6ef63a
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
首届“分子植物”国际研讨会:从模式植物到作物在上海成功举办
第二届“分子植物”国际学术研讨会在清华大学成功召开
免疫系统清理“RNA病毒”之谜解开

人体免疫系统衰老密码解开
解码免疫系统,“免疫图谱卓越计划”全面升级
胎儿拥有独特免疫系统

焦虑是如何削弱免疫系统的?

母体免疫系统为何不攻击胎儿

《自然》刊登上海团队成果:发现植物两大免疫系统协同抗敌
2017国际植物日之--南开大学站成功举办