科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-09-17
尽管针对胶质母细胞瘤 (GBM) 制定了新的治疗方案,但替莫唑胺 (TMZ) 耐药性仍然是主要障碍。 先前的研究已经表明异常 N6-甲基腺苷 (m6A) 修饰与 GBM 病理生物学有关。然而,m6A 修饰在 GBM 中 TMZ 抗性调节中的作用和精确机制仍不清楚。
2021年9月15日,赵蔚,刘庆及龙文勇共同通讯在Clinical and Translational Medicine 在线发表了题为“Interplay of m6A and histone modifications contributesto temozolomide resistance in glioblastoma”的研究论文,该研究证明了 TMZ 处理上调了 m6A 甲基转移酶 METTL3 的表达,从而增加了相关基因转录本的 m6A 修饰。需要 METTL3 来维持 GBM 干细胞的特征。当与 TMZ 结合时,METTL3 沉默以协同方式抑制原位 TMZ 抗性异种移植物的生长。从机制上讲,TMZ 通过提高 H3K27ac 水平和募集 RNA 聚合酶 II,诱导 SOX4 介导的 METTL3 位点染色质可及性增加。此外,METTL3 耗竭影响 m6A 在组蛋白修饰相关基因转录物(如 EZH2)上的沉积,导致无义介导的 mRNA 衰减。该研究揭示了 EZH2 在调节 METTL3 表达中的重要作用,这是通过 H3K27me3 修饰无关的方式。
总之,该研究结果揭示了 m6A RNA 修饰和组蛋白修饰在 TMZ 抗性中相互作用的基本机制,并强调了靶向 SOX4/EZH2/METTL3 轴在治疗 TMZ 抗性 GBM 中的治疗潜力。
替莫唑胺(TMZ)是当前一线抗胶质母细胞瘤(GBM)化疗药物,结合放疗可延长GBM患者生存时间[1]。但是不幸的是,至少有一半的GBM患者对TMZ不反应。更糟糕的是,大多数反应良好的患者最终会在治疗期间逐渐对TMZ产生耐药。TMZ耐药产生的原因除了MGMT去甲基化、错配修复和碱基切除修复机制以外,近期越来越多研究表明表观遗传调控因子、microRNA和LincRNA也参与其中[2, 3]。
m6A修饰是真核生物中分布最广泛的mRNA修饰,其可以调节RNA进程的各个方面,如RNA剪切,翻译和稳定性等,在肿瘤的发生发展中起着重要的作用[4, 5]。然而,m6A在GBM TMZ耐药中的作用尚不清楚。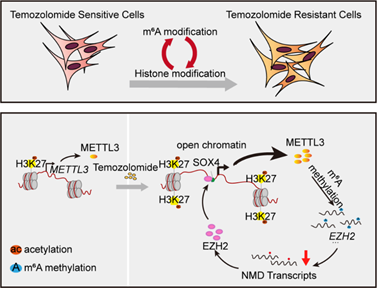
文章模式图(图源自Clinical and Translational Medicine )
在此研究中,赵蔚教授和刘庆教授团队利用miCLIP-seq (m6A单核苷酸分辨率交联与免疫沉淀测序)方法解析并比较TMZ敏感和耐药GBM组织中mRNA m6A修饰的差异,发现TMZ处理促进m6A甲基转移酶METTL3表达上调,从而增加组蛋白修饰调控因子mRNA上的m6A修饰。进一步研究表明在TMZ耐药GBM中,沉默METTL3有效抑制组蛋白修饰调控因子(如H3K27me3甲基转移酶EZH2)mRNA上m6A修饰,最终导致无意义介导的mRNA降解(NMD)。与此同时,还发现EZH2与SOX4形成复合物以H3K27me3非依赖的方式反过来调控METTL3的表达。更加重要的是,此研究通过体外细胞和小鼠颅内原位成瘤实验证实,靶向SOX4-EZH2/METTL3轴可以有效提升TMZ治疗效果。
综上所述,该研究发现m6A甲基转移酶METTL3和H3K27me3甲基转移酶EZH2形成调控回路,加剧GBM患者对TMZ药物的抵抗,靶向METTL3-EZH2轴使得耐药GBM重新对TMZ敏感。本研究为设计针对耐药GBM的新型治疗药物,提高耐药GBM患者疗效,改善预后有着积极的临床意义。
来源:iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247535719&idx=7&sn=ffeefe2990212e00d8d9ea4781c59eff
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Science子刊:首次3D打印出完整活体胶质母细胞瘤

鉴别出胶质母细胞瘤的致命“弱点” 有望开发出新型靶向性疗法
李辉教授团队从融合基因意外发现胶质母细胞瘤新靶标
赛诺菲MS药变身“子弹”,“炸掉”胶质母细胞瘤


新发现:circ2082促进胶质母细胞瘤细胞生长
肿瘤竟把免疫细胞关进“小黑屋”


Cell封面:单细胞测序揭示胶质母细胞瘤的“变形计”


胶质母细胞瘤分型研究获进展

人工智能“自学”,降低癌症治疗毒性
Cell Stem Cell:新研究揭示人胶质母细胞瘤的起源