科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-09-25
在细胞中,蛋白质等生物大分子可以通过液-液相分离组装成执行不同生理功能的无膜细胞器,如应激颗粒、P小体、核仁等【1】。
无膜细胞器通常处在高度动态的组装与解离过程。
这个过程受到胞内精密的动态调控,对其执行生理功能至关重要。
在病理情况下,无膜细胞器的动态调控紊乱会导致其所含的高度浓缩的蛋白质发生病理性液-固相转化。
这一过程与包括渐冻人症等在内的多种神经退行性疾病的发生密切相关【2】。
那么,细胞通过什么机制来对不同的无膜细胞器进行动态调控并有效抑制病理性蛋白聚集的呢?
中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪课题组与上海交通大学Bio-X研究院李丹课题组近年来的一系列合作研究表明,细胞中存在多种分子伴侣(如Hsp40,Hsp27,Hsp70以及NMNAT等)在无膜细胞器动态调控中起重要作用【3-6】(详见BioArt报道:PNAS | 李丹/刘聪合作揭示分子伴侣Hsp40通过相分离调控无膜细胞器动态组装的分子机制;Cell Research | 刘聪/方燕姗合作阐释Hsp70调控渐冻人症病理蛋白TDP-43相分离稳态的分子机制;刘聪/李丹合作揭示Hsp27在调控液液相分离和液固相转化中的作用;eLife、JBC| 李丹组报道阿尔兹海默致病Tau蛋白液固相变调控的新机制)。
此类研究逐步揭示了以分子伴侣调控网络为核心的胞内无膜细胞器动态调控机制。
基于在本领域中的工作积累,近日,刘聪与李丹近期受邀为Trends in Cell Biology撰写了题为 Spatiotemporal dynamic regulation of membraneless organelles by chaperone networks 的前沿综述文章(forum)。
该文章总结了近三年发表的分子伴侣调控无膜细胞器动态组装的工作,并在此基础上,提出了分子伴侣在胞内通过构成空间上广泛分布的、时间上多层调节的网络,来动态调控不同无膜细胞器的理论观点。
最后,作者探讨了通过调控分子伴侣网络重塑无膜细胞器动态平衡来抑制蛋白病理聚集的方法,为相关神经退行性疾病的药物研发提供了新的思路。
该文章首先汇总了近年来报导的多种调控蛋白相变的分子伴侣以及这些分子伴侣在调控蛋白相变中的不同功能。
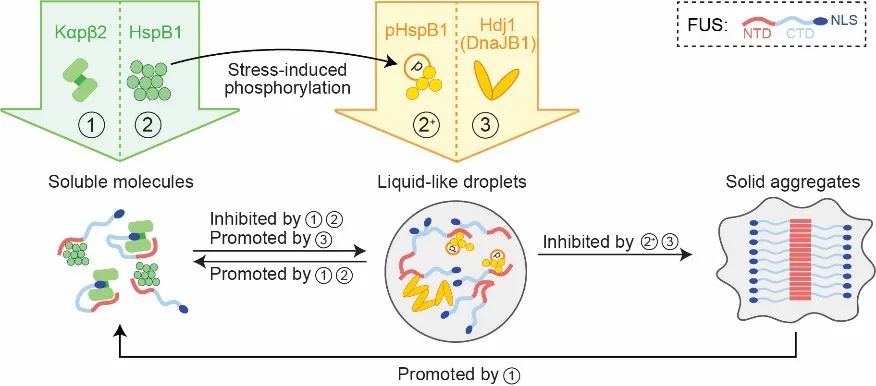
如图1所示,分子伴侣Kapβ2、Hsp27、Hsp40能够协同调控FUS蛋白相分离或相转化过程,并且不同的分子伴侣对蛋白相变过程展现出不同的调控方式和活性。
值得一提的是,翻译后修饰可以直接改变分子伴侣对蛋白相变的调控。
如Hsp27响应应激的磷酸化修饰,改变了Hsp27对FUS液-液相分离过程的抑制能力。
图1 不同分子伴侣协同调控FUS相分离或相转化过程进一步,作者提出了不同活性的分子伴侣通过组成时空特异的调控网络,来实现对空间上不同种无膜细胞器、同种但时间上处于不同阶段的无膜细胞器的动态调控。
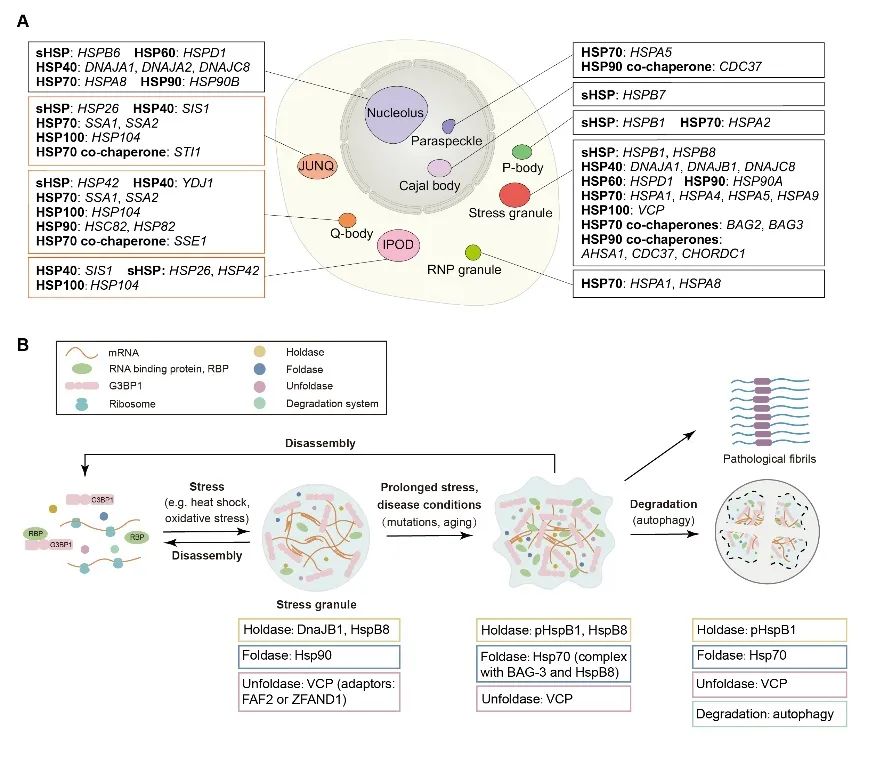
如图2A所示,分子伴侣广泛分布于不同种类的无膜细胞器中。
但各类无膜细胞器能够通过招募不同活性的分子伴侣,以不同的方式实现自身生化性质、功能以及稳态的调控。
又如图2B所示,在以应激时程或病理进程为衡量标准的时间尺度上,种类和功能各异的分子伴侣能够被不同阶段和状态的应激颗粒招募,并在应激颗粒的组装、解离和稳态维持过程中执行多层次的功能。
图2 实现无膜细胞器时空调控的分子伴侣网络最后,作者总结并展望了由分子伴侣调控网络受损导致的无膜细胞器调控紊乱与特定神经退行性疾病发病的关系,提出了可以通过调控分子伴侣网络来重塑无膜细胞器动态平衡,抑制致病蛋白病理性聚集的策略,为实现相关神经退行性疾病的干预和治疗提供新的思路。
原文链接:https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(21)00165-3参考文献1. Banani, S.F., Lee, H.O., Hyman, A.A. & Rosen, M.K. Biomolecular condensates: organizers of cellular biochemistry. Nature reviews. Molecular cell biology 18, 285-298 (2017).2. Alberti, S. & Hyman, A.A. Biomolecular condensates at the nexus of cellular stress, protein aggregation disease and ageing. Nature reviews. Molecular cell biology 22, 196-213 (2021).3. Gu, J. et al. Hsp40 proteins phase separate to chaperone the assembly and maintenance of membraneless organelles. Proceedings of the National Academy of Sciences of the United States of America 117, 31123-31133 (2020).4. Liu, Z. et al. Hsp27 chaperones FUS phase separation under the modulation of stress-induced phosphorylation. Nature structural & molecular biology 27, 363-372 (2020).5. Gu, J. et al. Hsp70 chaperones TDP-43 in dynamic, liquid-like phase and prevents it from amyloid aggregation. Cell research (2021).6. Ma, X. et al. Nicotinamide mononucleotide adenylyltransferase uses its NAD(+) substrate-binding site to chaperone phosphorylated Tau. eLife 9 (2020).本文转载自公众号“BioArt”(BioGossip)中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
微信号:BSC-1979

来源:BSC-1979 中国生物物理学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NjE1NTQ5Mg==&mid=2649510850&idx=2&sn=89ef2f267e6102517a13c4674b290be1
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn