科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-18
来源:BioArt
放射治疗是最主要的肿瘤治疗手段之一。但是放射抵抗仍然是导致放射治疗失败的主要因素,极易导致肿瘤的复发和转移。通常联合使用特定化学药物,对放疗提供增敏作用,并杀伤未发现的远处转移灶。放射治疗利用高能电离辐射(Ionizing radiation)产生DNA双链断裂,从而诱导周期停滞、衰老或不同方式的细胞死亡,包括凋亡,坏死,自噬和有丝分裂灾难等。除了直接损伤DNA外,电离辐射还可以通过间接效应对生物体发生作用。例如,电离辐射可以通过细胞水的辐射分解和氧化酶的刺激产生诸如氧自由基和过氧化氢的活性氧(Reactive oxygen species,ROS),从而损坏核酸、蛋白质和脂质并引起细胞损伤乃至死亡【1,2】。然而,放疗是否能够诱导其它未知的细胞死亡方式及其在放疗抵抗中的作用仍未可知。
铁死亡(Ferroptosis)是一种铁依赖的脂质过氧化物(Lipid peroxidation)介导的程序性死亡,其形态学改变和发生机制均不同于凋亡。目前的研究表明,铁死亡主要是由含有多不饱和脂肪酸磷脂(PUFA-PLs)的过氧化引起,而PUFA-PLs形成的过程需要一个关键蛋白ACSL4。通过基因编辑手段敲低ACSL4的表达即可抑制铁死亡的发生,表明ACSL4具有促进铁死亡的能力。细胞内的一种谷胱甘肽过氧化物酶GPX4,可以利用还原型谷胱甘肽将脂质氢过氧化物转化为脂质醇,从而减轻脂质过氧化作用并抑制铁死亡。谷胱甘肽是由甘氨酸、谷氨酸和半胱氨酸(cysteine)合成的,其中半胱氨酸是该合成过程的限速前体。大多数细胞通过氨基酸转运体SLC7A11(也称为xCT)输入细胞外胱氨酸(cystine)来获得半胱氨酸。相应地,通过遗传或药理学方法抑制GPX4或SLC7A11可诱发铁死亡。而这些诱导铁死亡的小分子化合物被称为铁死亡诱导剂(Ferroptosis-inducing agents,FINs)【3,4】。
越来越多的研究表明铁死亡在抑制肿瘤方面发挥重要作用。哥伦比亚大学的顾伟教授团队在2015年发表在Nature上的文章证明,促凋亡能力缺失的p53突变体可仍然可以通过调控铁死亡抑制肿瘤细胞生长【5】。德克萨斯大学MD安德森癌症研究中心甘波谊教授团队2018年发表在Nature Cell Biology上的文章揭示,抑癌基因BAP1通过表观遗传学水平调控H2A-K119ub进而抑制SLC7A11表达从而促进铁死亡发挥抑癌作用【6】。2019年密歇根大学的邹伟平教授团队发表在Nature上的文章发现基于靶向PD-L1和CTLA-4的肿瘤免疫治疗可以诱发T细胞调控肿瘤细胞铁死亡信号通路,进而促进铁死亡以响应免疫治疗【7】。随着日益增多的研究报道,铁死亡(ferroptosis)在肿瘤治疗中的作用机理和应用价值愈发明晰,由此引发的有趣问题是:铁死亡是否在放射治疗导致的肿瘤细胞死亡和抑制中扮演重要角色?FINs是否可作为新型强效的放射增敏剂来克服放疗抵抗?
2020年1月16日,美国德克萨斯大学MD安德森癌症研究中心的甘波谊教授课题组与中南大学湘雅医学院附属肿瘤医院王晖教授团队合作在Cell Research上发表长文文章The role of ferroptosis in ionizing radiation–induced cell death and tumor suppression,发现放射治疗可以通过诱导铁死亡发挥重要的抑癌作用。

甘教授课题组的博士生雷光和张义磊博士通过一系列检测手段发现,放疗可以通过产生大量ROS,并上调关键酶ACSL4的表达,共同促进脂质过氧化,最终导致铁死亡。并且在肿瘤细胞中敲除ACSL4基因导致明显的放射抵抗。电子显微镜观察发现放疗后肿瘤细胞呈现典型的铁死亡形态学变化—线粒体浓缩,膜密度增高,线粒体脊减少。这些发现提示铁死亡在放疗导致的细胞死亡中占重要地位,那么铁死亡是否也在放射抵抗中发挥作用呢?
该课题组研究人员发现放射治疗诱发铁死亡的同时,还诱导了肿瘤细胞的一种适应性反应—包括SLC7A11和GPX4在内的铁死亡抑制基因的表达也显著上调。而过表达SLC7A11和GPX4的肿瘤细胞呈现明显的放疗抵抗。肺癌中KEAP1高发突变,而突变的样本中也与SLC7A11高表达显著相关。深入研究发现,在肺癌细胞中抑制KEAP1可以上调SLC7A11基因表达并导致细胞抵抗铁死亡和放疗。以上研究结果表明环境压力比如放疗或遗传学变异比如KEAP1基因突变促使细胞抵抗铁死亡的同时也导致了放疗抵抗。
临床治疗中亟待解决的问题是,如何克服铁死亡和放疗抵抗以及避免放疗失败。甘教授课题组用肺癌细胞系测试了I,II,III类FINs的放射增敏作用,发现所有测试的FINs联合放疗都可以协同诱导脂质过氧化和铁死亡,并且明显增加癌细胞对放疗的敏感性。在体内实验中,用H460移植瘤模型发现,放疗有效地抑制了H460异种移植肿瘤的生长,尽管单独的ACSL4敲出或liproxstatin-1处理不会影响肿瘤的生长,但是在放疗后,ACSL4敲出或liproxstatin-1处理都可以显著恢复肿瘤的生长。免疫组化分析发现,放疗降低了肿瘤组织中的Ki67水平,并增加了phospho-H2AX,cleaved caspase-3以及4-羟基-2-壬醛(4-HNE,脂质过氧化标记物)的水平。重要的是,在放疗后,ACSL4敲出或liproxstatin-1处理可显着降低4-HNE水平,而不会影响Ki67,phospho-H2AX或cleaved caspase-3水平。这些发现进一步表明,铁死亡至少在放疗诱导的体内肿瘤抑制中占重要地位。与此同时,利用PDX等肿瘤动物模型发现,联用FINs抑制SLC7A11或GPX4,可以明显增强放疗疗效(协同作用),并逆转放射抵抗。
更为重要的是,在匹配的放疗前和放疗后患者样本中发现,作为铁死亡标志物的脂质过氧化产物的副产物4-HNE在放疗后均有不同程度的增多,进一步通过临床随访数据分析发现,4-HNE的免疫组织化学染色水平与患者的放疗疗效和无疾病生存时间(Disease-free survival)呈正相关,提示铁死亡的发生在临床放疗疗效中发挥重要作用。
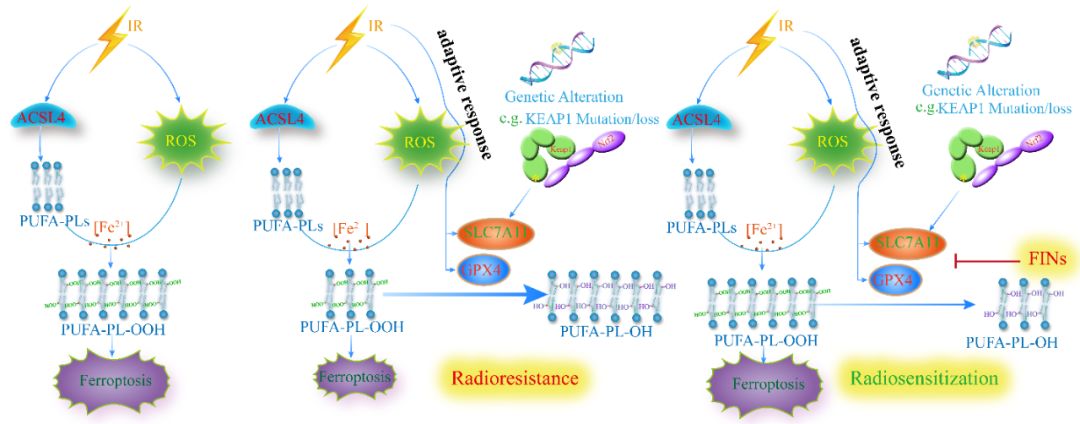
总而言之,这一研究揭示了放射治疗通过调控ACSL4、SLC7A11和GPX4建立了与铁死亡之间的密切联系,放疗可以诱导铁死亡, 并且铁死亡在放疗导致的细胞死亡和肿瘤抑制中占重要地位。进而指出一种潜在的肿瘤治疗新策略—放疗联合FINs,提供了新的途径来解决放疗抵抗的难题。

MD Anderson 癌症中心博士研究生雷光(左一)和张义磊博士(右一)为本论文共同第一作者,甘波谊教授(中)为通讯作者。
原文链接:
https://doi.org/10.1038/s41422-019-0263-3
参考文献
1. Baidoo KE, Yong K, Brechbiel MW. Molecularpathways: targeted alpha-particle radiation therapy. Clin Cancer Res 2013; 19:530-537.
2. AzzamEI, Jay-Gerin JP, Pain D. Ionizing radiation-induced metabolic oxidative stressand prolonged cell injury. Cancer letters2012; 327:48-60.
3. Ferroptosis: ARegulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell 2017; 171:273-285.
4. Doll S,Proneth B, Tyurina YY et al. ACSL4dictates ferroptosis sensitivity by shaping cellular lipid composition. Nature chemical biology 2017; 13:91-98.
5. Jiang, L., Kon, N.,Li, T. et al. Ferroptosis as a p53-mediated activity during tumour suppression.Nature 520, 57–62 (2015) doi:10.1038/nature14344
6. Zhang, Y., Shi, J.,Liu, X. et al. BAP1 links metabolic regulation of ferroptosis to tumoursuppression. Nat Cell Biol 20, 1181–1192 (2018) doi:10.1038/s41556-018-0178-0
7. Wang, W., Green,M., Choi, J.E. et al. CD8+ T cells regulate tumour ferroptosis during cancerimmunotherapy. Nature 569, 270–274 (2019) doi:10.1038/s41586-019-1170-y
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652480005&idx=4&sn=7e1aba9e4bf51b51e1acfc16c5ef2a42&chksm=84e231b1b395b8a729508940928491853c6af19ac5cf8d65ab88e6198d52b4d64e9a28302a12#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中国抗癌协会肿瘤护理专业委员会在津成立



中国抗癌协会肿瘤介入学专业委员会换届会议召开



中国科大揭示肿瘤细胞代谢重编程与周期调控新机制

中年人要担心的不只是油腻,45岁起就该开始结直肠癌筛查

肿瘤干细胞研究取得进展

能治疗癌症的 除了放疗、化疗……还有光!
“蛋结构”材料能有效杀伤肿瘤细胞
肿瘤干细胞最新研究进展!

全新给药方式可降低癌症复发率

肿瘤微环境,如何分析、指导癌症治疗?