科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-10-09
该工作揭示了聚集态蛋白质在微结构与种类上的极性差异性,并建立了蛋白质聚集态极性与其致病能力的相关性。
细胞内蛋白质的错误折叠与聚集会引发多种蛋白质构型疾病,如阿尔兹海默症、帕金森症、渐冻人症和心肌淀粉样变等。
早期针对聚集态蛋白质的研究通常聚焦于其聚集态形貌与聚集过程的生化机理。
然而,针对其本身物理和化学性质(如极性、粘稠度、氧化还原性质、酸碱度、化学反应性等)的定量信息相对匮乏。
此外,近期多项研究显示,聚集态蛋白质的这些理化性质与其致病机制有密切关系。
课题组在前期多种聚集态蛋白质探针(Anal. Chem.,2021;Angew. Chem. Int. Ed.,2021;Angew. Chem. Int. Ed.,2021;Chem. Sci.,2021)的研究基础上,进一步发展出一类同时具有对极性微环境和聚集态蛋白质敏感度的荧光探针(AggRetina)。
该类探针可选择性结合聚集态蛋白质,并根据其内部极性微环境的不同发出不同波长的荧光。
利用所构建的波长与极性的线性关系,科研人员可定量测量不同蛋白质聚集态的极性差异性。
这种极性差异性与其蛋白酶解速率密切相关,从分析化学的角度侧面阐释了其致病性。
通过活细胞荧光成像,该探针在胞内观察到致病蛋白质所形成的聚集体具有结构上的异质性。
该工作为后期进一步通过蛋白质组学分析聚集态蛋白质组提供了新的研究方向。
来源: 中科院之声
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NzIyNDI1Mw==&mid=2651803023&idx=2&sn=815e5ba106357cf7d242a6712b8eb19f
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nature子刊:利用蛋白质快速光化学氧化与质谱连用解析蛋白质高级结构

评论:学术人才之虑在“质”而非“量”

武汉物数所蛋白质动态学研究新技术助力重要蛋白结构解析

用突变基因,解码蛋白质结构

CopulaNet:深度学习蛋白质结构预测新进展
AlphaFold 2再发350000种蛋白质结构预测结果,解锁98.5%人类蛋白质组!

中国海洋湖沼学会理事张奇研究员主持的《鄱阳湖水文情势变化研究》出版发行
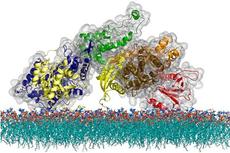
科学家揭示胞内致病聚集态蛋白质极性异质性

关于召开第十一届全国采矿学术会议的通知
蛋白质之间发生了什么?