科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-10-12
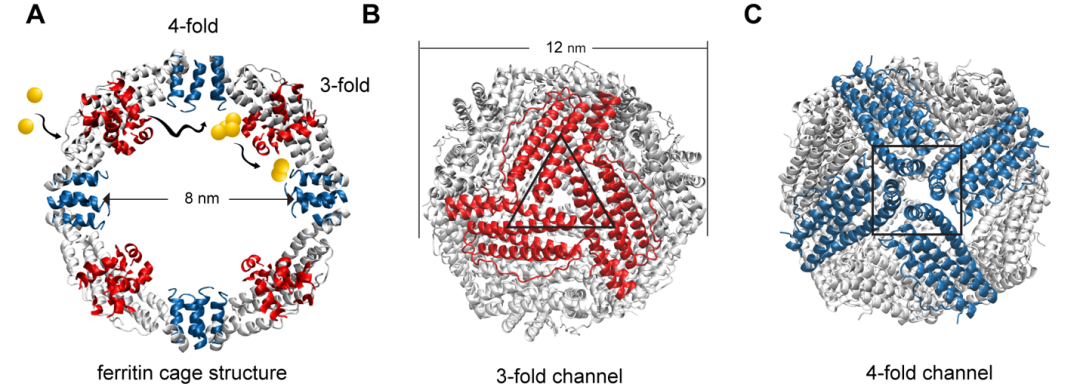
铁蛋白是一类广泛存在于几乎所有生命形式中的铁储存蛋白,包括动物、细菌、原核生物、植物和昆虫。
其 24 个亚基自组装形成一个外径约为 12 nm 内径约为 8nm 的球形蛋白质笼。
由于独特的结构特征、鲁棒性和均匀的尺寸,以去铁铁蛋白(apo-ferritin)作为骨架来锚定金属离子进而制备纳米材料受到广泛重视。
然而,对于金属离子进入去铁铁蛋白空腔的微观机制尚不清楚,限制了纳米材料的理性设计和可控制备。
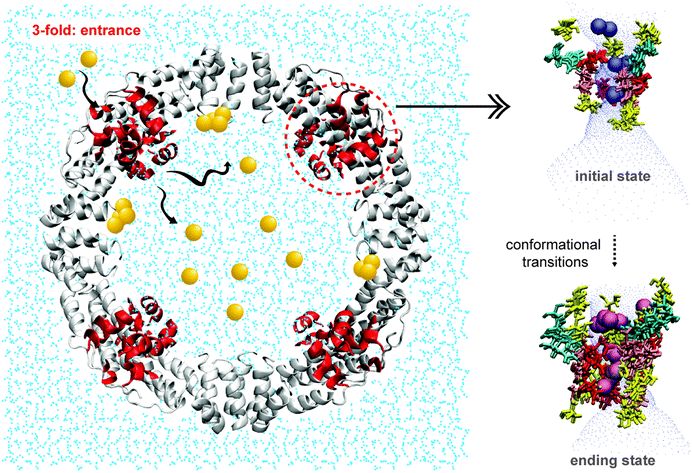
近日,清华大学卢滇楠副教授和刘铮教授带领研究团队采用分子动力学模拟和马尔可夫状态模型 (MSM)相结合的方法在原子水平上展示了 Au(III) 从溶液装载到去铁铁蛋白笼的完整运输路径。
该成果以“The synergistic mechanisms of apo-ferritin structural transitions and Au(iii) ion transportation: molecular dynamics simulations with the Markov state model”为题,发表在英国皇家学会期刊 Physical Chemistry Chemical Physics 上,并入选为期刊封面文章。
该工作辨认出了去铁蛋白笼内部存在 8 个Au(III)结合位点和 5 个 3 倍通道;其中 His118、Asp127 和 Glu130 的构成Au(III) 离子运输的门控开关。
采用马尔科夫状态模型( MSM) 分析和 Potential of mean force(PMF) 计算表明 Glu130 附近存在能垒,Au(III) 离子主要运输途径是:3 倍通道位点 3 → 内腔位点 5 → 内腔位点 6。
这些结果为进一步利用去铁铁蛋白进行合理设计和制备新型纳米材料提供了启示和理论指导。
来源:RSC英国皇家化学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzAxNjE4NTE5MQ==&mid=2651117352&idx=1&sn=2063c8e6c87d014979957b834abcc18e
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

纳米材料间“拉链”性能首获系统认知

精准!日本科学家制造出可用于纳米材料装配的机器人
铁蛋白载药机制研究获进展

铁蛋白探针精准靶向肝癌研究获进展
尿液运铁蛋白
人酸性铁蛋白
核酸药物找到新“壳” 铁蛋白当上“快递员”
生物物理所铁蛋白载药机制研究获进展

不忘报国心,段镶锋助力纳米材料科研发展
可溶性转铁蛋白受体测定