沈梦林
加好友
沈梦林 2021-12-31
为何新冠病毒奥密克戎变异株的感染性显著增强?我国科学家联手解开了奥密克戎变异株刺突蛋白及其与受体和抗病毒抗体的复合物结构,从蛋白构象上,解开了其感染性增强的谜团。该研究论文今天已在线刊登于预印本bioRiv网站。
新冠疫情爆发至今,已进化出多种 “令人担忧的变异毒株”,不断给全球的疫情防控带来不确定性和新的挑战,特别是最新出现Omicron变异株,正在全球肆虐,引起了新一轮的感染高峰。统计显示,目前每天新增感染已近100万病例,其中80%左右感染者是由Omicron变异株引起。
新冠病毒Omicron变异株的突变位点数量明显多于近2年流行的所有新冠病毒变异株,尤其在病毒刺突蛋白突变就多达37处。目前,有关这些突变如何影响Omicron变异株的感染性以及导致免疫逃逸机制都不清楚。而近期的研究显示,目前针对新冠病毒超过80%的中和抗体对Omicron变异株无效,或效力显著降低,因此深入理解Omicron变异株的传播和感染的分子机制,并开发针对Omicron变异株的特异性治疗抗体迫在眉睫。
中科院上海药物研究所徐华强和尹万超团队紧急攻关,在不到一个月的时间内迅速解析Omicron变异株刺突蛋白以及结合人源受体ACE2的高分辨率冷冻电镜结构(图1A和1B)。
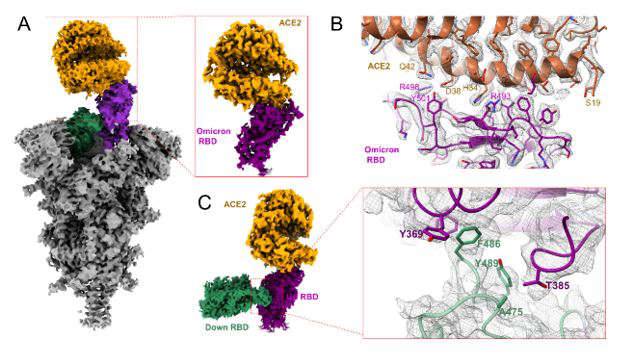
图1 Omicron突变株新冠病毒刺突蛋白结合受体ACE2的结构。A展示结构整理构象,B为RBD结合ACE2的相互作用界面,C为RBD二聚体的相互作用界面。
生化水平结合显示,Omicron变异株刺突蛋白的受体结合区域(receptor-binding domain,RBD)结合受体ACE2相对于野生型有显著的增强,大概提高了近10倍。
热动力学实验显示,Omicron变异株的RBD高度灵活,而且不稳定,使得刺突蛋白更容易从闭合构象向开放构象转换。
同时,科学家从解析的结构观察到了Omicron变异株刺突蛋白三聚体内相邻RBD特异的相互作用,形成的RBD二聚体(图1C),可以稳定Omicron变异株的刺突蛋白特定的RBD处于开放的状态。
“这些Omicron变异株刺突蛋白RBD的不稳定性和及其相互作用,使得更容易Omicron变异株刺突蛋白与受体ACE2相互作用。”徐华强介绍,这些研究从原子水平解释了Omicron变异株传染性增强的问题,“同时,我们解析的结构显示Omicron变异株刺突蛋白的大部分突变位点都位于蛋白表面,包括多个抗原表位,这从结构上解释了Omicron变异株可以抵抗大部分中和抗体的分子机制”。
在此工作基础上,徐华强和尹万超团队联合济民可信邓俗俊团队,攻克了Omicron变异株刺突蛋白与特异性治疗抗体JMB2002的结构(图2A-D)。该抗体已完成了一期临床试验,具有较强的治疗效果和较高的安全性。生化水平结合实验显示,该抗体对Omicron变异株刺突蛋白的结合力是对野生型的4倍,显示出强大的抑制Omicron变异株的潜力。
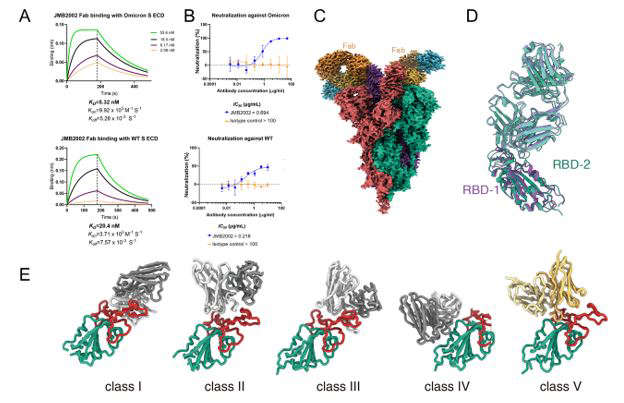
图2 Omicron突变株新冠病毒刺突蛋白结合抗体JMB2002的结构。A展示JMB2002抗体片段分别与Omicron突变株和野生型新冠病毒刺突蛋白的结合,B展示JMB2002抗体分别对Omicron突变株和野生型的抑制,C为Omicron突变株新冠病毒刺突蛋白结合抗体JMB2002的结构,D为结合JMB2002抗体片段RBD的结构比较,E为抗新冠病毒中和抗体的分类,JMB2002抗体为新型抗体,被归为第五类。
“从解析获得的复合物结构中,我们发现JMB2002抗体片段以一种新的构象结合在RBD的受体结合基序的背部,是新型作用机制的抗体(图2E)。”徐华强说,“结合生化和抗病毒中和实验,我们阐述了抗体JMB2002具有广谱抗新冠病毒的分子机制”。