科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2022-07-26
真核细胞中约1/3的蛋白质是分泌蛋白和膜蛋白,这些蛋白质往往富含二硫键。新生肽链中二硫键的形成过程称为蛋白质氧化折叠。内质网拥有一整套包括折叠酶和分子伴侣在内的“质量控制”系统为蛋白质氧化折叠提供保障。此外,内质网腔偏氧化的环境有利于二硫键形成,例如,内质网的谷胱甘肽还原电位(EGSH)约为-200 mV,远高于胞浆(约-300 mV)。然而,内质网氧化还原稳态失衡和未折叠/错误折叠蛋白异常积累极易导致内质网应激和相关疾病。因此,探索细胞如何保证蛋白质氧化折叠的高效性和保真性,以及如何维持内质网氧化还原稳态,具有重要的科学意义。
7月20日,中国科学院生物物理研究所研究员王磊与中科院院士王志珍应邀共同在Trends in Biochemical Sciences上,在线发表了题为Oxidative protein folding fidelity and redoxtasis in the endoplasmic reticulum的综述文章。基于课题组在本领域多年的系统研究,该论文全面地总结了酵母、植物和哺乳动物的蛋白质氧化折叠机制,重点阐述了维持蛋白质氧化折叠保真性和内质网氧化还原稳态的机制,深入讨论了蛋白质氧化折叠保真性在不同病理和生理中的作用以及靶向蛋白质氧化折叠进行疾病干预的可能性。
真核细胞内质网中巯基氧化酶Ero1和蛋白质二硫键异构酶PDI构成了催化蛋白质氧化折叠的主要通路。本文提出蛋白质氧化折叠保真性及内质网氧化还原稳态的维持主要依赖于两种机制:(1)Ero1氧化酶决定内质网较为氧化的环境,它的活性被其“调控环”上的各种翻译后修饰(PTMs)精确控制。Ero1活力的快速精准调节,一方面有利于维持蛋白质氧化折叠的效率,另一方面可将内质网的过度氧化风险降至最低。(2)高等真核生物丰富的PDI家族成员在蛋白质氧化折叠过程中表现出分工不同,它们协同工作以保证二硫键形成的高效性和保真性。未来,针对Ero1-PDI系统的深入研究,将有助于科学家更好地探究蛋白质氧化折叠的调节机制,同时,开发靶向Ero1-PDI相互作用的特异性抑制剂将有助于相关疾病的治疗。
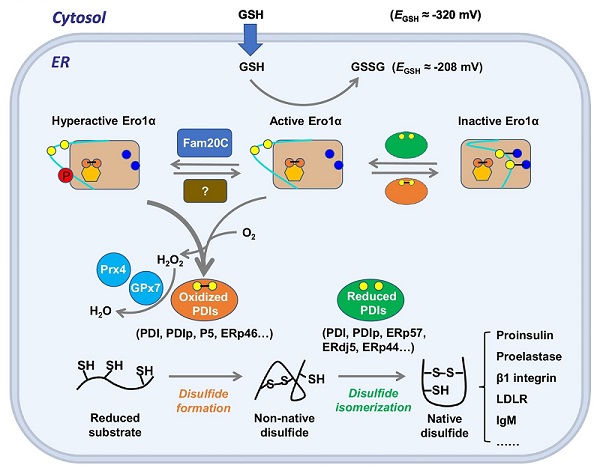
Ero1α-PDI维持人细胞内质网中蛋白氧化折叠保真性和氧化还原稳态
内容来源:中国科学院来源:中国科学院
原文链接:http://www.cas.cn/syky/202207/t20220722_4842738.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
研究揭示内质网还原应激加速衰老
蛋白质之间发生了什么?
位阻手性二硫键——药物“靶向释放”的调控开关
中科院科学家研究发表植物内质网相关蛋白质降解机制综述文章
Cell亮点:内质网稳态和长寿新机制
武汉病毒所在杆状病毒二硫键形成通路研究方面取得进展
JACS:自由基取代合成不对称二硫键
揭示内质网P5AATPase/CATP-8通过清除异位蛋白维持内质网“身份”
生物物理所提出靶向内质网蛋白质氧化折叠通路治疗宫颈癌新策略

地理快讯|全球变化科学研究数据出版系统"获得第八届中国数字出版博览会"创新项目"荣誉