科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2023-08-01
作者:甘晓 来源:中国科学报
全肿瘤细胞疫苗(TCV)是经典的个体化肿瘤免疫疗法,由于其免疫原性弱且引起的免疫反应个体差异大,亟需通过学科交叉发展新理念和新技术,实现按需免疫增效。
近日,中国科学院过程工程所(以下简称过程工程所)生化工程国家重点实验室与中国科学院大学化学科学学院合作,创建了新型全肿瘤细胞疫苗平台,依据肿瘤进展情况在接种部位按需实施近红外光照,以此实现最佳的脉冲免疫增效。相关工作于7月26日发表在《自然-通讯》上。
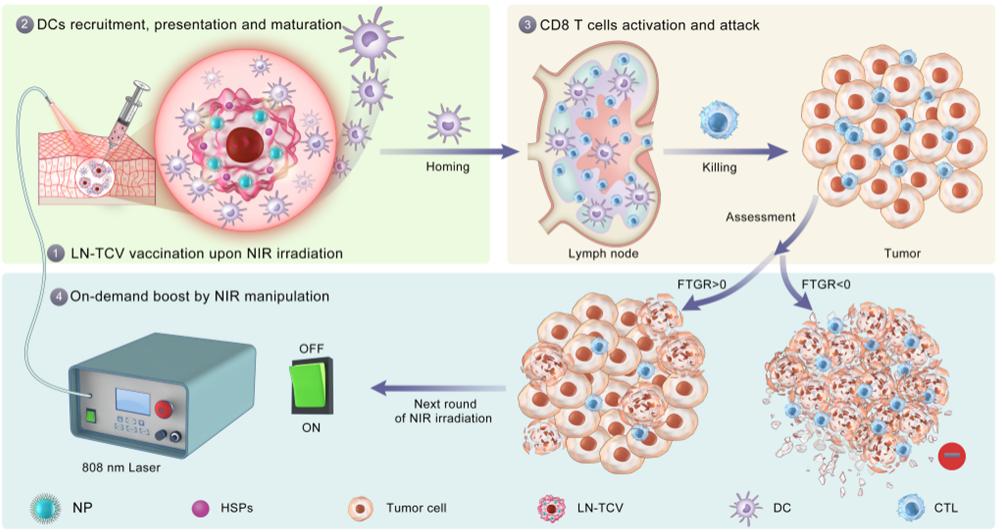 近红外照射调控全肿瘤细胞疫苗免疫反应的作用机制(科研团队供图)
近红外照射调控全肿瘤细胞疫苗免疫反应的作用机制(科研团队供图)
肿瘤疫苗通过调动机体免疫系统来对抗肿瘤,是极具前景的肿瘤免疫疗法。其中,全肿瘤细胞疫苗包含了患者所有潜在的肿瘤抗原,可以通过多价免疫应答减少免疫逃逸,进而实现更加精准的个体化免疫治疗。
但是,科研人员看到,以往的全肿瘤细胞疫苗均需通过经验式的多次接种来维持免疫反应,患者的肿瘤样本较为珍贵,使得疫苗的制备和存储存在较大困难,并且难以针对患者个体充分发挥免疫疗效。
面对上述挑战,在中国科学院院士马光辉、研究员魏炜研带领下,过程工程所生化工程国家重点实验室的科研人员基于肿瘤免疫治疗及生物剂型工程的多年研究基础,与中国科学院大学化学科学学院田志远教授展开交叉合作研究。
研究团队首先发展了新的全肿瘤细胞疫苗制备过程,将具有光热效应的纳米颗粒负载于肿瘤细胞中,通过近红外光照诱导肿瘤细胞产生内源性免疫佐剂热休克蛋白,反复冻融后形成“光控型全肿瘤细胞疫苗(LN-TCV)”。
单次免疫后,近红外光照诱导接种部位的温热反应可产生温和的炎症效应,进而招募抗原提呈细胞并促进了后续的抗肿瘤免疫反应。
在此基础上,研究团队还提出了用于监测肿瘤生长速率波动的新指标(FTGR),以此理性指导在接种部位提供近红外光照的最佳时机,使得脉冲增效能够精准契合肿瘤的发展进程。
上述LN-TCV在多种细胞来源的肿瘤异种移植模型(CDX)以及人源化的患者来源肿瘤异种移植模型(PDX)中展现出了非常显著的治疗效果,证明了“光控免疫”的新理念在肿瘤疫苗中的先进性和优越性。
据研究人员介绍,上述成果仍属于临床前研究,实际临床疗效仍有待进一步验证。鉴于该体系构建的通用性和灵活性,未来转化研究时以期实现全肿瘤细胞疫苗从肿瘤细胞扩展到肿瘤组织的混合细胞,也可以通过可穿戴贴片式LED和远程控制系统扩展临床适用场景,实现更加便捷和高效的个体化治疗。
中国科学院大学博士研究生孟佳琦、过程工程所副研究员吕岩霖、中国科学院大学博士鲍威尔为该论文共同第一作者,过程工程所研究员魏炜、中国科学院院士马光辉、中国科学院大学教授田志远为共同通讯作者。
该工作得到了国家自然科学基金、北京自然科学基金、国家重点研发计划和中国科学院战略性先导科技专项的支持。
相关论文信息:https://doi.org/10.1038/s41467-023-40207-y