科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-02
来源:BioArt
撰文 | 小飞飞
 图1 CRISPR-Cas9 多基因编辑T细胞示意图
图1 CRISPR-Cas9 多基因编辑T细胞示意图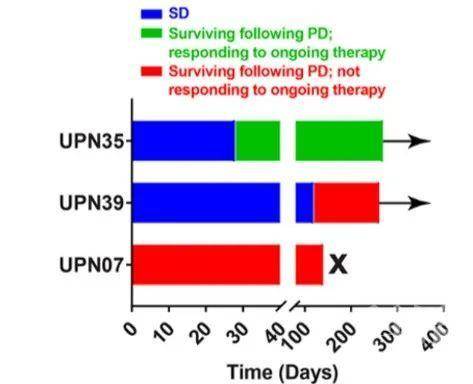 图2 三名病人临床反应概况
图2 三名病人临床反应概况参考文献
1. Lim WA, June CH. The Principles of EngineeringImmune Cells to Treat Cancer. Cell. 2017;168(4):724–740.2. Provasi E, Genovese P, Lombardo A, et al. Editing Tcell specificity towards leukemia by zinc finger nucleases and lentiviral genetransfer. Nat Med. 2012;18(5):807–815.3. Odorizzi PM, Pauken KE, Paley MA, Sharpe A, WherryEJ. Genetic absence of PD-1 promotes accumulation of terminally differentiatedexhausted CD8+ T cells. J Exp Med. 2015;212(7):1125–1137.4. Rapoport AP, Stadtmauer EA, Binder-Scholl GK, etal. NY-ESO-1-specific TCR-engineered T cells mediate sustained antigen-specificantitumor effects in myeloma. Nat Med. 2015;21(8):914–921.来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652481656&idx=1&sn=0d102293ff4bc799168f835588e57f5c&chksm=84e23bccb395b2dadfa4691861eb6b6f08e037b14d307df510a5d5c2da00b3bb3c82d2220f14&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
研究发现CRISPR-Cas9基因编辑系统在灵长类中不会导致明显的脱靶效应

一种超快的CRISPR-Cas9基因编辑技术 几秒钟内实现精准基因编辑!
超越CRISPR-Cas9的“DNA碎纸机”
新型光敏CRISPR-Cas9系统实现基因编辑的光调控
真相:桃子和西瓜一起吃有剧毒?谣言卷土重来,你又信了?
意外突变!CRISPR-Cas9应用依旧任重道远
石远凯的面对面视频
石远凯:探索抗癌新药
华中农大棉花团队建立四倍体棉花CRISPR-Cas9高效单碱基基因编辑系统
Cell:首次发现阻断CRISPR-Cas9基因组编辑的小分子抑制剂