科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-02
来源:中国科学杂志社
背景介绍
肿瘤的复杂性、多样性以及非均相性,促使其临床或临床前治疗研究由单一治疗转向多模协同治疗研究。近年来,多种治疗模式的联合使用跃然成为基础研究的热点,这样不仅可以有效克服每种单一治疗模式的弊端,还可以充分发挥每种治疗模式之间的相互增强作用,从而达到协同增效效果。
成果简介
最近,为了发展新型的肿瘤协同治疗策略,深圳大学黄鹏教授团队设计和构建了葡萄糖氧化酶修饰的上转换纳米探针,用于程序性的肿瘤饥饿-光动力协同治疗研究,该研究成果以题为“Programmable starving-photodynamic synergistic cancer therapy”的封面文章发表于Science China Materials。
葡萄糖氧化酶催化氧化肿瘤组织内葡萄糖并产生过氧化氢,从而消耗葡萄糖,使肿瘤细胞缺乏营养物质处于“饥饿”状态,导致细胞死亡。此外,在近红外光激发下,上转换纳米颗粒激发产生紫外可见光,将双氧水裂解成毒性更强的羟基自由基,从而进一步杀死肿瘤细胞。体外和体内实验均证实这种饥饿-光动力协同治疗效果明显优于任何单一治疗。
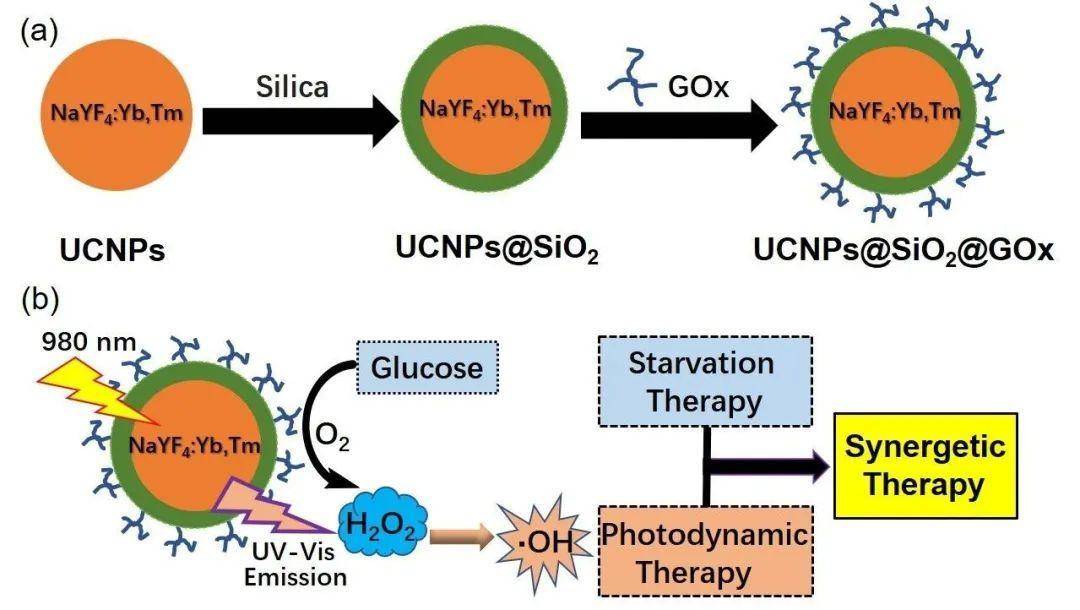
研究意义
该研究为设计程序可控的饥饿-光动力协同治疗提供了理论支撑,为肿瘤协同治疗提供了一种新的策略。图文导读

Figure 1 材料表征:该文中纳米探针的透射电镜图。表明制备得到的该系列纳米探针尺寸均一(直径~75 nm)。
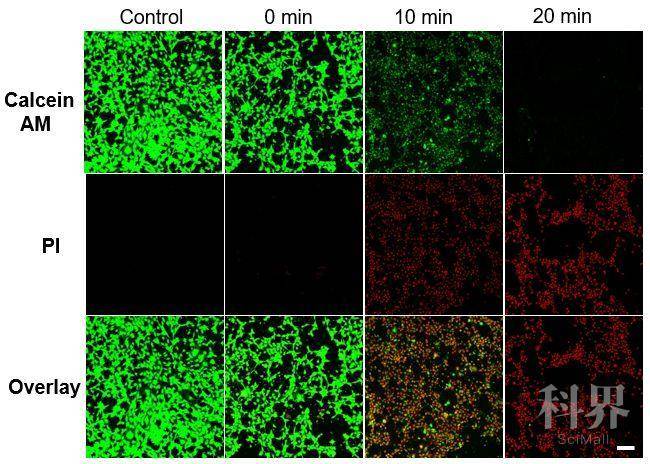
Figure 2 体外细胞实验:在980 nm激光照射下,纳米探针对4T1肿瘤细胞的杀伤效果。结果表明纳米探针展现出光剂量依赖的肿瘤细胞杀伤效果。
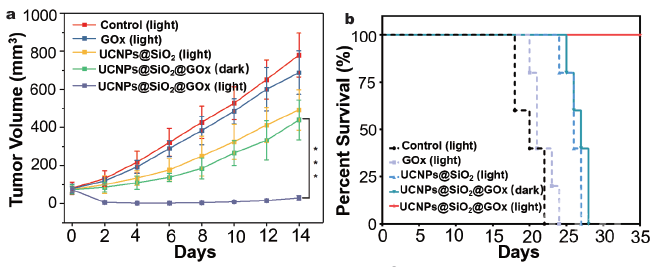
Figure 3 活体肿瘤协同治疗效果:荷瘤小鼠的4T1肿瘤生长曲线(a)和生存周期(b)。实验结果表明该纳米探针(UCNPs@SiO2@GOx)在光照条件下,可高效抑制4T1肿瘤的生长,并有效延长荷瘤小鼠的生存周期。
总结
该研究发展了一种新型的肿瘤协同治疗策略,利用葡萄糖氧化酶修饰的上转换纳米探针,成功地实现了程序性的肿瘤饥饿-光动力协同治疗。来源:scichina1950 中国科学杂志社
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQ5MzQyNA==&mid=2656802766&idx=1&sn=876acafa0b817cd11e15161e6435dd86&chksm=84a10911b3d680070040f5296a8768850a2cf490c78984bcc389b85c466597e0afd9221448c8#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中国抗癌协会肿瘤介入学专业委员会换届会议召开



线粒体靶向的“纳米导弹”用于光动力/光热协同癌症治疗
热烈祝贺中国光学学会常务理事顾瑛教授和姜会林教授当选院士
癌症光动力磁热协同治疗结合免疫治疗研究获进展
第一届纳米纤维素材料国际研讨会在杭州召开



专家解读:纳米机器人如何消灭肿瘤细胞?

《细胞》子刊:显著抑制恶性肿瘤生长,这个新靶点有望治疗数十种癌症

环钯金属配合物自组装成纳米棒,促进细胞吸收并用于光动力疗法治疗癌症

发现利用仿生脂蛋白调节肿瘤基质提高纳米药物靶向肿瘤细胞的新策略
肿瘤干细胞驱动的正反馈环路或可成为癌症治疗新靶点