科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-31
来源:BioArt
撰文 | 亨利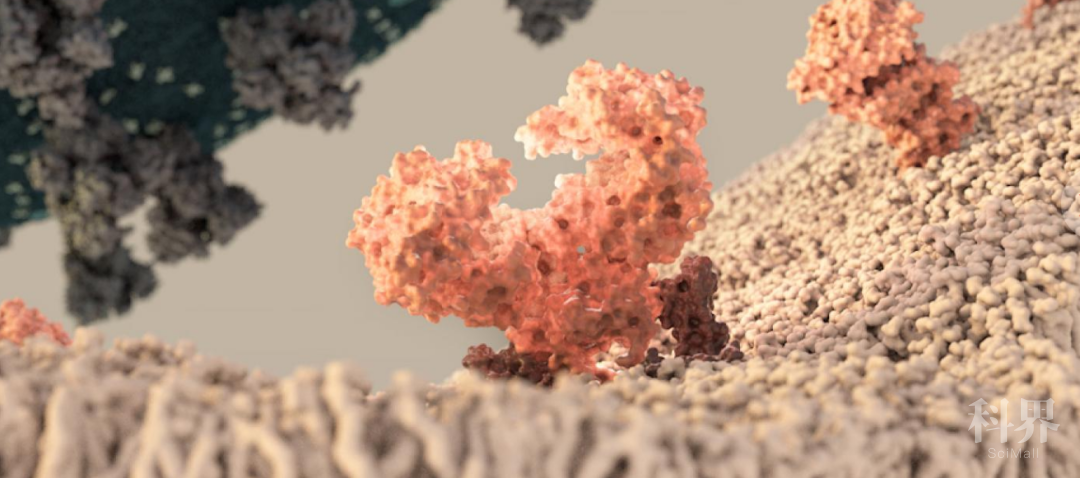

来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652482785&idx=1&sn=07c72d364c64be59e2e09d530c83c677&chksm=84e23f55b395b643713107935dc9dbcb1050659b475079ef9895029a304639277696f6d49abb#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
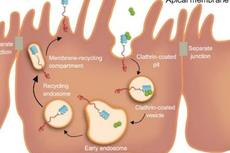
浙江大学刘树生团队首次发现昆虫传播植物DNA病毒的关键受体蛋白

重要! G蛋白偶联受体家族成员的结构解析

梁毅/刘聪合作团队解析朊病毒蛋白纤维冷冻电镜结构

新冠病毒受体亲和性为SARS的10-20倍:首次电镜解析S蛋白结构
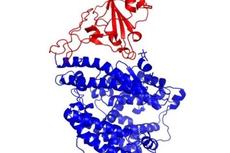
【学术前沿】新冠病毒S蛋白受体结合区域(RBD)与人受体ACE2复合物结构
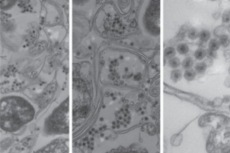
《自然》发文:麻省理工学院发现海洋中一种未知病毒

你身体里也有病毒基因:存在于众多生命中

艾滋病疫苗为何“难产”?

最新研究:流感病毒有望得到遏制

西湖大学周强团队成功解析新冠病毒细胞受体的空间结构