科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-07
内容来源:中国科学院重大科技基础设施共享服务平台
原标题:国家蛋白质科学研究(上海)设施核磁分析系统用户通过运用In-CellNMR等方法揭示脂质分子质膜相分离调控蛋白结构与功能的机理
北京时间2020年3月30日凌晨,国际著名学术期刊《Nature Communications》在线发表了上海有机化学研究所生物与化学交叉中心刘聪课题组与上海交通大学Bio-X研究院李丹课题组合作的最新研究成果“Different regions of synaptic vesicle membrane regulate VAMP2 conformation for the SNARE assembly”。该研究通过联合运用细胞内核磁共振波谱(in-cell NMR)为主的多种方法方法,系统研究了突触小泡膜上的脂质分子局部相分离形成的微区(microdomain)决定突触小泡相关膜蛋白2(vesicle associated membraneprotein2, VAMP2)膜外无序区的动态三维结构,并进而调控其在SNARE复合体组装与神经递质传递中的生理功能。
细胞内环境复杂,充斥着多种有膜和无膜的细胞器、小分子和其他生物分子等等。如此拥挤和粘稠的细胞内环境会影响蛋白质的结构状态和生理功能,尤其是对缺乏稳定三维结构的内在无序蛋白质。因此,在越是接近生理的环境中研究它们的分子结构,越有可能揭示其真正的功能机理。近些年发展的in-cell NMR技术是一种有效的蛋白质原位分子结构解析手段,可以非损伤地获取细胞内特定蛋白质的动态结构和与其它分子的相互作用的信息。
神经细胞突触的神经递质释放依赖于突触小泡与突触前膜的融合。突触小泡膜上的VAMP2蛋白和突触前膜的syntaxin-1,及SNAP25蛋白相互识别并组装形成SNARE(N-乙酰马来酰亚胺敏感因子结合蛋白受体)复合体。VAMP2属于典型的内在无序蛋白质,其从酵母到哺乳动物细胞都具有高度保守的核心SNARE motif结构域。虽然对于VAMP2形成SNARE复合体的结构研究已非常细致, 但VAMP2在形成复合体之前的动态结构在领域内一直存在较大的争议。该工作通过In-cell NMR技术首次观察到VAMP2的SNARE motif直接结合到细胞内膜上。更为有趣的是,改变细胞内胆固醇的水平可以直接调控SNARE motif在细胞内结合膜的动态结构(如图1所示)。
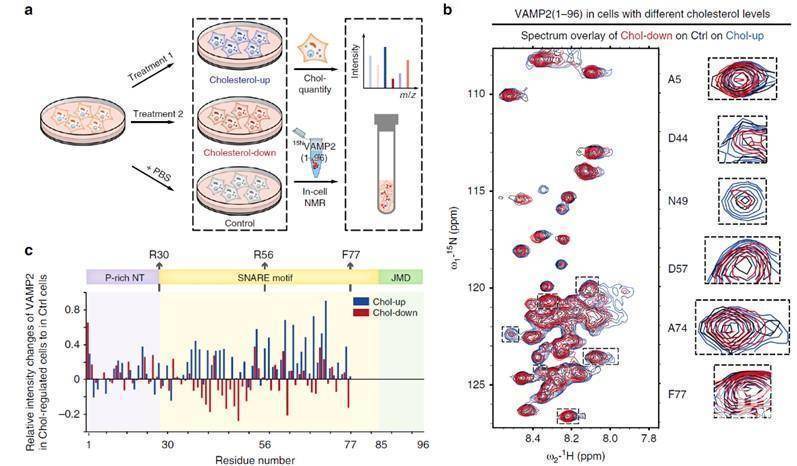
图1:In-cell NMR试验表明VAMP2在细胞内的构象受到胞内胆固醇含量的直接调控 (Wang, C., et al. Nat. Commun., 2020)
进一步通过结合脂质组学分析、solution NMR以及荧光单分子膜泡技术,研究者发现VAMP2蛋白的SNARE motif在突触小泡膜的不同脂质区域的构象是不同的。当VAMP2定位在突触小泡胆固醇富集的microdomain上时,其SNARE motif更偏向于无序结构,使其易于同syntaxin-1和SNAP25识别并组装形成SNARE复合体。当VAMP2定位在突触小泡膜的非胆固醇富集区时,其SNARE motif更倾向于形成α-螺旋结构并结合在膜上,从而抑制其参与SNARE复合体组装。综上,这项工作通过联合运用in-cell NMR及其它技术手段系统地研究了突触小泡膜上脂质分子相分离形成的microdomain从而精密地调控VAMP2的结构以及其在SNARE组装中的功能(如图2所示)。
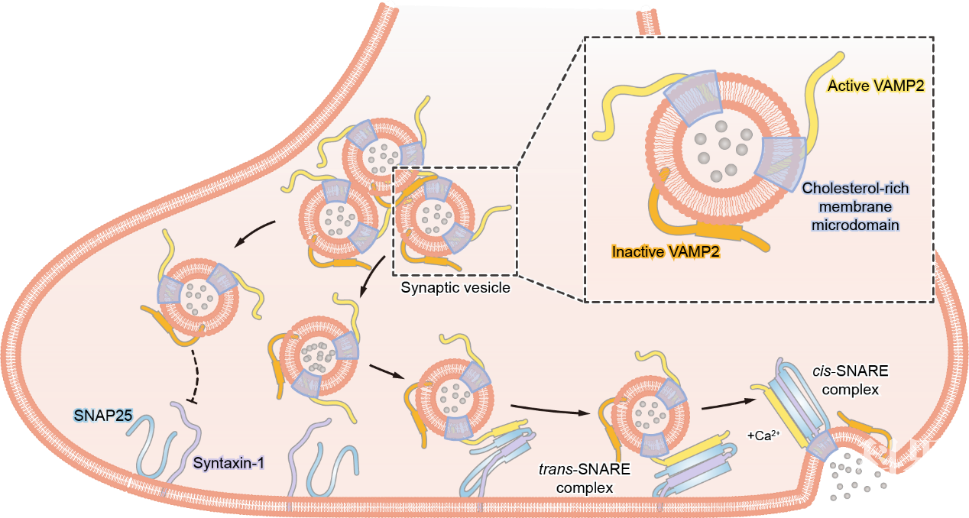
图2:VAMP2在突触小泡膜不同区域上的构象及其参与SNARE复合体组装的模型 (Wang, C., et al. Nat.Commun., 2020)
该工作为SNARE组装的脂质调控增加了新的空间维度,也给胆固醇代谢疾病引起的突触分泌异常提供了可能的机理解释,为脂代谢异常引起的神经系统疾病提供新的治疗靶点和技术方法。另外需要特别指出的是, 本工作还进一步表明,除了目前如火如荼进行的各种不同蛋白质相分离调控生物学过程的研究外,脂质分子在细胞及各种细胞器膜上的二维相分离对于调控直接插膜或膜表面结合蛋白的空间构象以及相应的生理功能起到了非常重要的调控作用。
该文章有2位共同第一作者,分别是王楚楚和涂嘉博士。上海有机化学研究所刘聪研究员与上海交通大学的李丹教授是共同通讯作者。该研究工作获得国家蛋白质科学研究(上海)设施核磁系统刘志军博士的大力支持,刘博士帮助在900兆核磁谱仪上建立了In-cell NMR图谱的快速采集和动力学实验方法,对于该研究工作的开展发挥了重要作用。
文章链接:https://www.nature.com/articles/s41467-020-15270-4
来源:中国科学院重大科技基础设施共享服务平台
原文链接:http://lssf.cas.cn/lssf/dbzkxyjshss/xwdt/202004/t20200407_4555389.html
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

在细胞外“存活”的蛋白质

研究发现逆转细胞老化关键蛋白质
Molecular Plant 出版“植物激素”专辑

人工智能预测蛋白质结构(新知)

我科学家为活细胞蛋白质安装“调控开关”
小分子-膜蛋白质互作界面和结构调控分析研究获进展
环境友好的农林害虫生态调控与生物防治技术——2017高级研修班总结

无形的指挥棒——光裂解“分子胶水”调控蛋白质-蛋白质相互作用
从健康细胞到癌细胞,或许只需要几个突变
蛋白质之间发生了什么?