科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-08
来源:生物学霸
在细胞治疗大行其道的当今,CAR-T 疗法占据半壁江山,但在实体瘤方面的应用却颇受掣肘。
近日,发表在 Nature Biotechnology 杂志上的一项研究中,来自宾夕法尼亚大学医学院的科学家团队找到了 CAR-T 疗法的「升级版」——嵌合抗原受体-巨噬细胞(CAR-M),可以打破局限,能够杀死实验室人类样本和小鼠模型中的肿瘤[1]。这一研究让战斗力惊人的巨噬细胞再次引起科研猿的关注。(友情提示:文末有彩蛋,不要错过哦~)
不同活化方式,不同功能特征
传统上,巨噬细胞曾被称为分泌促炎和抗微生物介质的抗原递呈吞噬细胞[2]。然而,越来越多的证据表明,巨噬细胞存在多种表型,执行不同的功能,可以诱导周围的细胞和组织产生不同的效应。
Stein 等首次发现「替代性」活化的巨噬细胞(M2 型巨噬细胞),有别于「经典」活化的巨噬细胞(M1 型巨噬细胞)的表型[3],从而开创性地建立了巨噬细胞分类的两大模型。两种表型对于先天性和适应性免疫系统都很重要。
经典活化的 M1 型巨噬细胞显示出 Th1 样的表型,促进炎症、细胞外基质(ECM)的破坏以及细胞凋亡,倾向于引起慢性炎症和组织损伤;而替代性活化的 M2 型巨噬细胞则显示出 Th2 样的表型,促进 ECM 构建、细胞增殖以及血管生成,倾向于消除炎症反应和促进伤口愈合[4-7]。
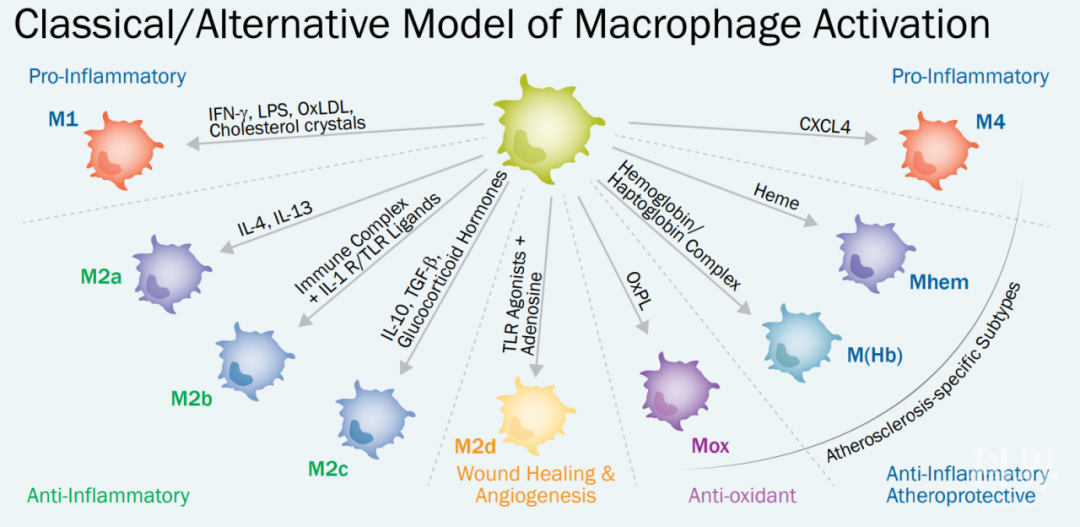
巨噬细胞活化的多维新模型
在肿瘤微环境中,M2 型巨噬细胞被认为是重要的帮凶。Saar Gill 博士团队的这篇研究发现,CAR-M 表达的促炎细胞因子和趋化因子,可将促肿瘤 M2 型巨噬细胞转化为抗肿瘤 M1 型巨噬细胞[1]。接下来让我们了解两种活化方式的详细通路图。
经典活化的 M1 型巨噬细胞
初始巨噬细胞首先经 IFN-γ/IFN-γ 受体(IFN-γR)信号启动分化[8-9],当该巨噬细胞受到合适的刺激,如细菌的 LPS,它就变成经典活化的巨噬细胞。LPS 首先与可溶性的 LBP 结合,随后与可溶性或膜结合的 CD14 结合。
CD14 将 LPS 释放至包含 TLR410 和 MD-2 的 LPS 识别复合物[10,12]。病原体和病原体成分随后被吞噬,并传递给溶酶体,暴露于多种降解酶中[14]。抗原被加工后,在内吞作用后期加载到 MHC Ⅱ类分子上,然后抗原/MHC II 复合物和共刺激分子 B7 家族成员被呈递给 T 细胞[15]。
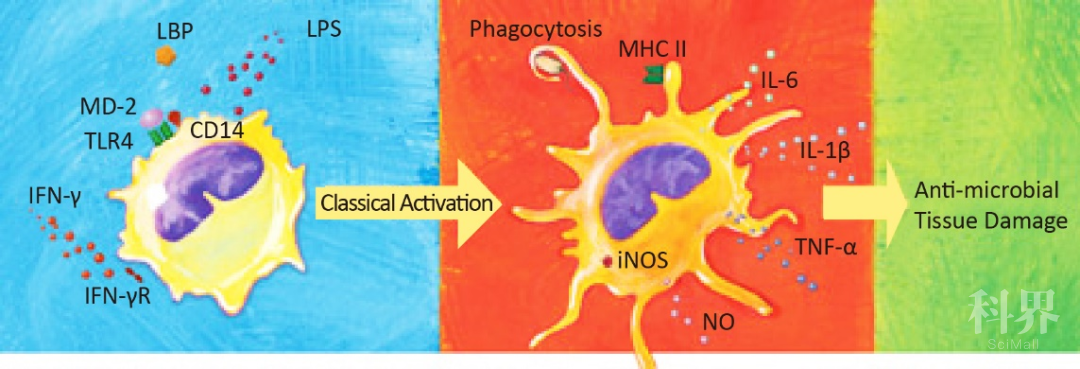
经典活化的巨噬细胞通路图
紧随其后,巨噬细胞形态和细胞分泌因子发生显著变化:
释放多种趋化因子,包括 IL-8/CXCL8、IP-10/CXCL10、MIP-1α/CCL3、MIP-1β/CCL4 和 RANTES/CCL5,从而吸引嗜中性粒细胞、未成熟树突状细胞、自然杀伤细胞和活化的 T 细胞[16];
释放 IL-1β/IL-1F2、IL-6 和 TNF-α/TNFSF1A 等促炎细胞因子[4-7]。TNF-α 也有助于经典活化巨噬细胞的促凋亡活性[17-19],TNF-α 伴随着 Fas Ligand/TNFSF6 的分泌[17] 和因 iNOS 上调引起的 NO 释放[20-23];
释放 MMP-1、-2、-7、-9 和 -12 等蛋白水解酶,降解胶原蛋白、弹性蛋白、纤连蛋白和其它 ECM 组分[24-26];
经典活化的巨噬细胞通过诱导大量的白细胞浸润,并使周围组织充满炎症因子、促凋亡因子和基质降解酶,一旦失控,会拆解组织从而造成严重损伤。慢性炎症引起的组织破坏与肿瘤的发生发展、Ⅰ型自身免疫性疾病、肾小球肾炎等病症有关[5,7]。
替代性活化的 M2 型巨噬细胞
替代性活化的 M2 型巨噬细胞的分化不需要任何启动程序,IL-4[3]、IL-10、IL-13[27] 等因子即可诱导活化。这些因子与其各自的受体结合后,引起可溶性抗原的液相胞饮[28-30]。可溶性抗原随后被加载到 MHC Ⅱ 类分子上,然后抗原/MHC II 复合物和共刺激分子 B7 家族成员被呈递到 T 细胞[15]。

替代性活化的巨噬细胞通路图
与经典活化的 M1 型巨噬细胞类似,替代性活化的 M2 型巨噬细胞在相应刺激下也会发生细胞形态和细胞分泌模式的改变。
白细胞被巨噬细胞释放的趋化因子 MDC/CCL22[31,32]、PARC/CCL18[33,34] 和 TARC/CCL17[32] 所吸引;
炎症反应被释放的因子如 IL-1ra/IL-1F3[35]、Ym1、Ym2、RELMa[36,37]、IL-10[7] 和 TGF-β 所抵消。TGF-β 也可通过诱导临近的成纤维细胞产生 ECM 成分而间接促进 ECM 的构建[19];
替代性活化的 M2 型巨噬细胞可自分泌 ECM 成分,如纤连蛋白、bIG-H3[38]、ECM 交联酶、转谷氨酰胺酶[37] 以及骨桥蛋白,参与细胞粘附[39];
此外,替代性活化的巨噬细胞能上调精氨酸酶 Ⅰ,其参与脯氨酸和多胺的生物合成。脯氨酸促进 ECM 的构建,多胺参与细胞增殖[20]。替代性活化的巨噬细胞分泌的其它促进细胞增殖的因子包括 PDGF、IGF 和 TGF-β[19,41],这些因子和碱性 FGF、TGF-α 及 VEGF 共同参与血管生成[41,42]。
替代性活化的 M2 型巨噬细胞分泌的因子具有抗炎、促纤维化、促进增殖和血管生成的活性,因而,可以消退炎症、促进创伤修复。替代性活化的巨噬细胞对于抵抗寄生虫例如血吸虫病的感染也极为有效。除此之外,此类巨噬细胞与过敏和哮喘的发生相关[4,5]。
两种活化形式的巨噬细胞各司其职,掌握体内的免疫平衡,任何一方肆意发展,都会破坏免疫稳态,引发众多疾病。
参考文献
[1].Michael Klichinsky et al. (2020) Human chimeric antigen receptor macrophages for cancer immunotherapy. Nature Biotechnology.
[2].Gordon, S. (1999) "Macrophages and the immune system." in Fundamental Immunology, 4th Ed., Paul, W.E., ed., Lippincott-Raven Publishers, Philidelphia, pp. 533-545.
[3].Stein, M. et al. (1992) J. Exp. Med. 176:287.
[4].Duffield, J.S. (2003) Clin. Sci. 104:27.
[5].Gordon, S. (2003) Nat. Rev. Immunol. 3:23.
[6].Ma, J. et al. (2003) Cell. Mol. Life Sci. 60:2334.
[7].Mosser, D.M. (2003) J. Leukoc. Biol. 73:209.
[8].Dalton, D.K. et al. (1993) Science 259:1739.
[9].Huang, S. et al. (1993) Science 259:1742.
[10].Janeway, C.A. & R. Medzhitov (2002) Annu. Rev. Immunol. 20:197.
[11].Takeda, K. et al. (2003) Annu. Rev. Immunol. 21:335.
[12].Nagai, Y. et al. (2002) Nat. Immunol. 3:667.
[13].Greenberg, S. & S. Grinstein (2002) Curr. Opin. Immunol. 14:136.
[14].Honey, K. & A.Y. Rudensky (2003) Nat. Rev. Immunol. 3:472.
[15].Harding, C.V. et al. (2003) Curr. Opin. Immunol. 15:112.
[16].Luster, A.D. (2002) Curr. Opin. Immunol. 14:129.
[17].Boyle, J.J. et al. (2003) Arterioscler. Thromb. Vasc. Biol. 23:1553.
[18].Duffield, J.S. et al. (2001) Am. J. Pathol. 159:1397.
[19].Song, E. et al. (2000) Cell. Imunol. 204:19.
[20].Hesse, M. et al. (2001) J. Immunol. 167:6533.
[21].Thomassen, M.J. & M.S. Kavuru (2001) Int. Immunopharmacol. 1:1479.
[22].Duffield, J.S. et al. (2000) J. Immunol. 164:2110.
[23].Munder, M. et al. (1998) J. Immunol. 160:5347.
[24].Chizzolini, C. et al. (2000) J. Immunol. 164:5952.
[25].Gibbs, D.F. et al. (1999) Am. J. Respir. Cell Mol. Biol. 20:1136.
[26].Gibbs, D.F. et al. (1999) Am. J. Respir. Cell Mol. Biol. 20:1145.
[27].Doherty, T.M. et al. (1993) J. Immunol. 151:7151.
[28].Brombacher, F. (2000) BioEssays 22:646.
[29].Montaner, L.J. et al. (1999) J. Immunol. 162:4613.
[30].Conner, S.D. & S.L. Schmid (2003) Nature 422:37.
[31].Andrew, D.P. et al. (1998) J. Immunol. 161:5027.
[32].Imai, T. et al. (1999) Int. Immunol. 11:81.
[33].Kodelja, V. et al. (1998) J. Immunol. 160:1411.
[34].Goerdt, S. et al. (1999) Pathobiology 67:222.
[35].Mantovani, A.et al. (2001) Trends Immunol. 22:328.
[36].Raes, G. et al. (2002) J. Leukoc. Biol. 71:597.
[37].Loke, P. et al. (2002) BMC Immunol. 3:7.
[38].Gratchev, A. et al. (2001) Scand. J. Immunol. 53:386.
[39].Haroon, Z.A. et al. (1999) Lab. Invest. 79:1679.
[40].Murry, C.E. et al. (1994) Am. J. Pathol. 145:1450.
[41].Cao, B. et al. (2000) Chin. Med. J. 113:776.
[42].Sunderkötter, C. et al. (1991) Pharmac. Ther. 51:195.
来源:ShengWuXueBa 生物学霸
原文链接:https://mp.weixin.qq.com/s?__biz=MzA4OTQ1MTQxNg==&mid=2652072031&idx=1&sn=994c919c62bc2e7866b2b9b21e2b6580&chksm=8bfd76a8bc8affbee857de59dcd3ca4d10486dd5b37f5cca33e76a9edeebe57ded5a0540691b#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中国学者揭示肿瘤相关巨噬细胞新亚型的作用及机制
Adv. Mater.:人造自然杀伤细胞用于肿瘤特异性抑制和叛变巨噬细胞的再教育
我国学者发现炎症巨噬细胞凋亡机制
一个小小的细胞就有多达4200万个蛋白质分子

北京基因组所等揭示肿瘤相关巨噬细胞调控CD8+T细胞命运新机制
Cell Metabolism丨膜胆固醇外排驱动肿瘤相关巨噬细胞重编程和肿瘤发展
中国抗癌协会肿瘤护理专业委员会在津成立




Radiology:高级别胶质瘤肿瘤细胞中有多少巨噬细胞在躁动?

陈佩文博士等发现巨噬细胞与肿瘤细胞的互惠共生作用揭示新的抗肿瘤靶点
血管分泌因子Rspondin3调控间质巨噬细胞转换并溶解炎症性损伤