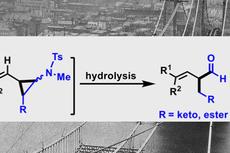
来源:X一MOL资讯
脂环胺是廉价易得的化工原料,如果能在其非活化的C-H键上进行官能团化生成C-C键或C-X键,无疑会制备更高附加值的杂环化合物,因为它们是许多生物活性/药物分子的砌块。尽管已经有大量的方法可以实现环胺的α-C-H键官能团化,但底物上的氨基均需要保护,从而阻碍了进一步的转化;而远程的C-H键官能团化则仅限于制备三级、N-芳基或N-酰基环胺;试图在环上两个不同位置同时进行C-H键官能团化的成功案例是极少的,三官能团化则更是未知的。
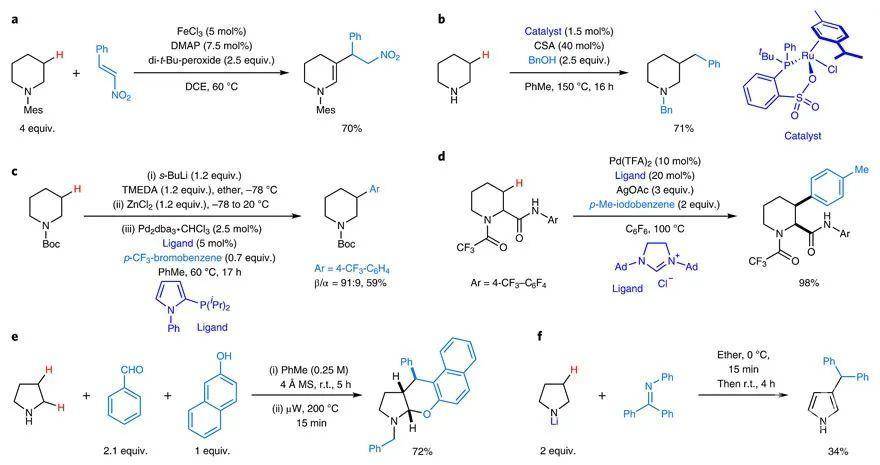
然而,与药物相关的脂环胺多数是含β-取代基的,有些甚至是多取代的,但目前制备这些砌块的路线比较繁琐,因此急需“一锅煮”的简单方法。通过文献调研,发现目前脂环胺上β-C-H键官能团化的策略主要有以下几种:1)通过氧化得到环内烯胺中间体后与恰当的受体(如β-硝基苯乙烯)偶联(下图a);2)钌催化的脂环胺(如哌啶)的β-烷基化(下图b);3)α-金属化的N-Boc胺发生β-H消除后,在钯催化下再发生β-芳基化反应(下图c);4)在α-甲酰胺的导向作用下,与芳基卤代物发生钯催化的交叉偶联反应实现β-芳基化,但氨基不保护的话无法反应(下图d);5)无金属介导的β-C–H键官能团化,但不可避免N-烷基化和α-C–H键官能团化(下图e);6)Wittig和Hesse等人曾报道N-锂化的吡咯烷也可发生β-C–H键官能团化,但会发生芳构化(下图f,Liebigs Ann. Chem., 1971, 746, 174–184; Liebigs Ann. Chem., 1971, 746, 149–173)。
脂环胺的β-C–H键官能团化。图片来源:Nat. Chem.受上述Wittig和Hesse等人开创性工作的启发,美国佛罗里达大学的Daniel Seidel 教授课题组实现了未保护脂环胺的α-C-H键官能化(下图g,Nat. Chem., 2018, 10, 165–169; J. Am. Chem.Soc., 2019, 141, 8778–8782)。他们认为N-锂化的脂环胺1(如哌啶)被酮氧化后原位生成亚胺2,并与有机金属亲核试剂发生加成得到α-取代的脂环胺。于是,他们设想能否在亚胺2上实现β-C-H键官能团化?具体而言,将亚胺2去质子化得到环内1-氮杂烯丙基负离子4,并与烷基化试剂反应生成β-烷基亚胺5,可还原成β-取代的哌啶6(下图h);也可进一步与亲核试剂加成得到α,β-双取代的哌啶8(下图i)。若上述设想能实现,自然也容易想到在过量酮存在下,或许能制备α,β,α′-三取代的脂环胺衍生物10(下图j)。近日,他们实现了二级脂环胺的区域选择性β-C-H键官能团化,并可以一次引入多达三个取代基,且不需要保护基或过渡金属。相关结果发表在Nature Chemistry 上,第一作者为博士后Weijie Chen博士。
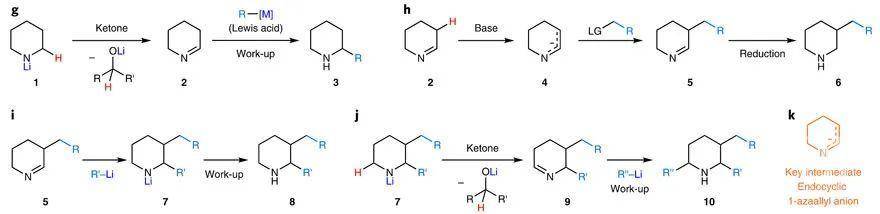
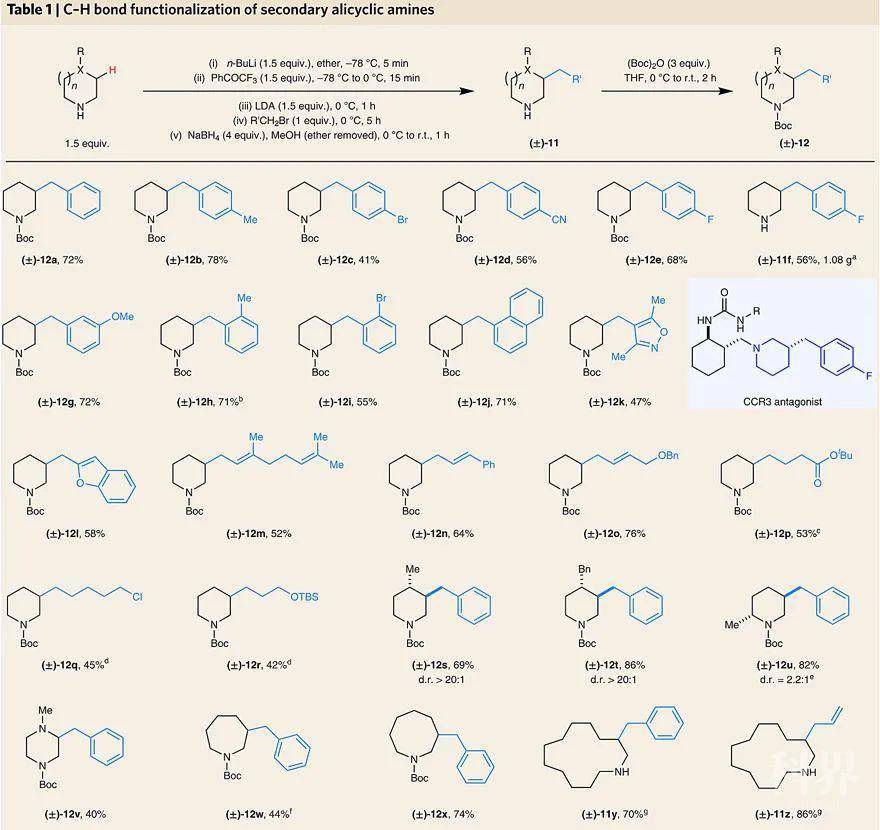
脂环胺的多重官能团化设想。图片来源:Nat. Chem.显然,以上设想实现的前提是能否生成环内1-氮杂烯丙基负离子4。然而,该类中间体不同于非环或环外的氮杂烯丙基负离子,它们可以选择性地在C端进行烷基化,目前报道的环内1-氮杂烯丙基负离子涉及的反应只有三氟乙酰化,但在C端和N端都能进行反应,并且可以与相应的亚胺(如5)加成,说明难以控制选择性。另外,制备这些环内1-氮杂烯丙基负离子的前体亚胺也是相当困难的,因为这些环内亚胺不仅有很强的角张力,而且还容易生成无法去质子化的三聚体。于是,研究人员通过加入三氟苯乙酮,便可原位制备环内亚胺,而生成环内1-氮杂烯丙基负离子的关键在于选择合适的碱,如LDA。对反应条件进行优化后,研究人员首先尝试脂环胺的β-C–H键单烷基化(下图)。结果显示,该反应在6-13元脂环胺上均能实现,并且官能团耐受性较好(如卤素、酯基、氰基、醚、烯烃和不同的杂环均不受影响),还能大大简化CCR3拮抗剂母核11f的制备(原本需要5步),且能以克级规模制备。另外,C4-取代的哌啶(如12s、12t)也能以较高的收率和优异的非对映选择性(> 20:1 d.r.)实现β-C–H键苄基化;2-甲基哌啶以82%的收率、2.2:1的非对映选择性实现区域选择性β′-苄基化,得到产物12u。值得一提的是,分子量较大的产物(如11y、11z)相对非极性,并容易以游离胺的形式分离。需要说明的是,为了方便分子量较小的化合物纯化,研究人员引入了Boc基团。
脂环胺的β-C–H键官能团化。图片来源:Nat. Chem.将上述条件中最后的硼氢化钠还原改成加入有机金属锂试剂,便能以中等至较好的收率从简单易得的脂环胺制备α,β-C–H键双官能团化的衍生物,并产生较好的非对映选择性,也不需要在纯化前进行N-Boc保护。值得一提的是,α,β-双官能化的仲胺产物是很有价值的砌块,有利于制备其他结构多样化的化合物,例如13r可转化为双环叔胺14。
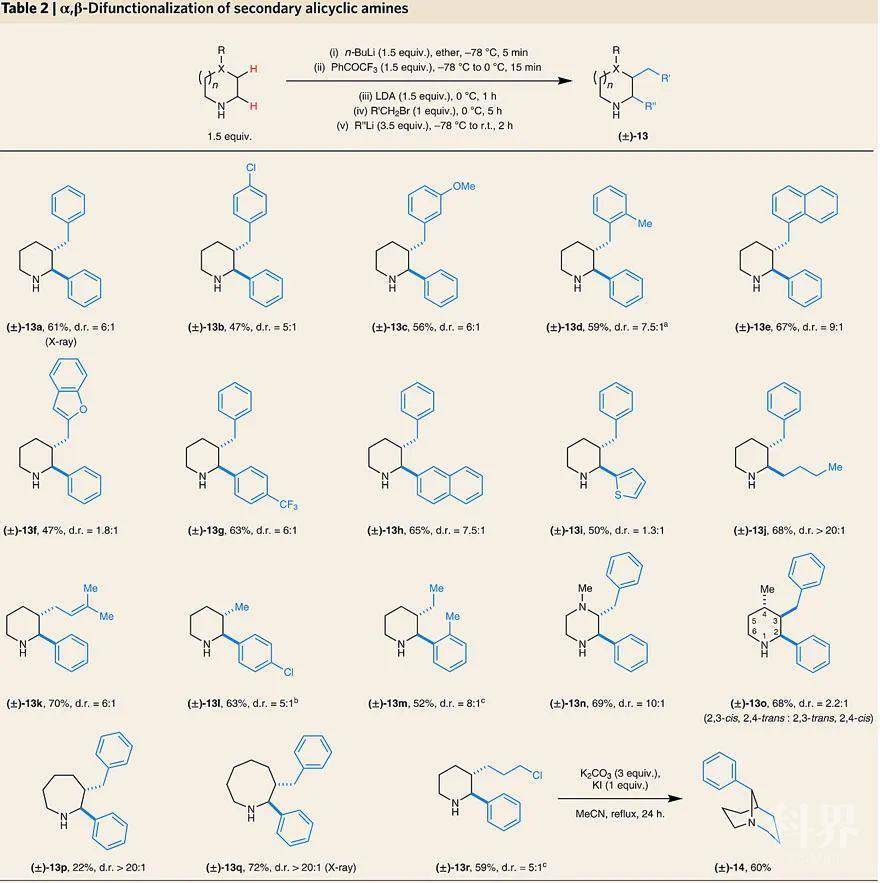
脂环胺的α,β-C–H键双官能团化。图片来源:Nat. Chem.同样地,研究人员通过加入2.5当量的三氟苯乙酮将上述α,β-双官能团化后的N-锂化中间体进行再次氧化,生成相应烯胺后加入正丁基锂试剂就能实现α,β,α′-C-H键三官能团化,并且具有很好的非对映选择性。值得一提的是,改变试剂的添加顺序便可改变取代基的位置,例如15a 和15b互为构造异构体。尽管脂环胺的α,β,α′-C-H键三官能化的产率较低,但在明确的环位置快速引入三个不同的取代基在药物研发过程中十分重要。
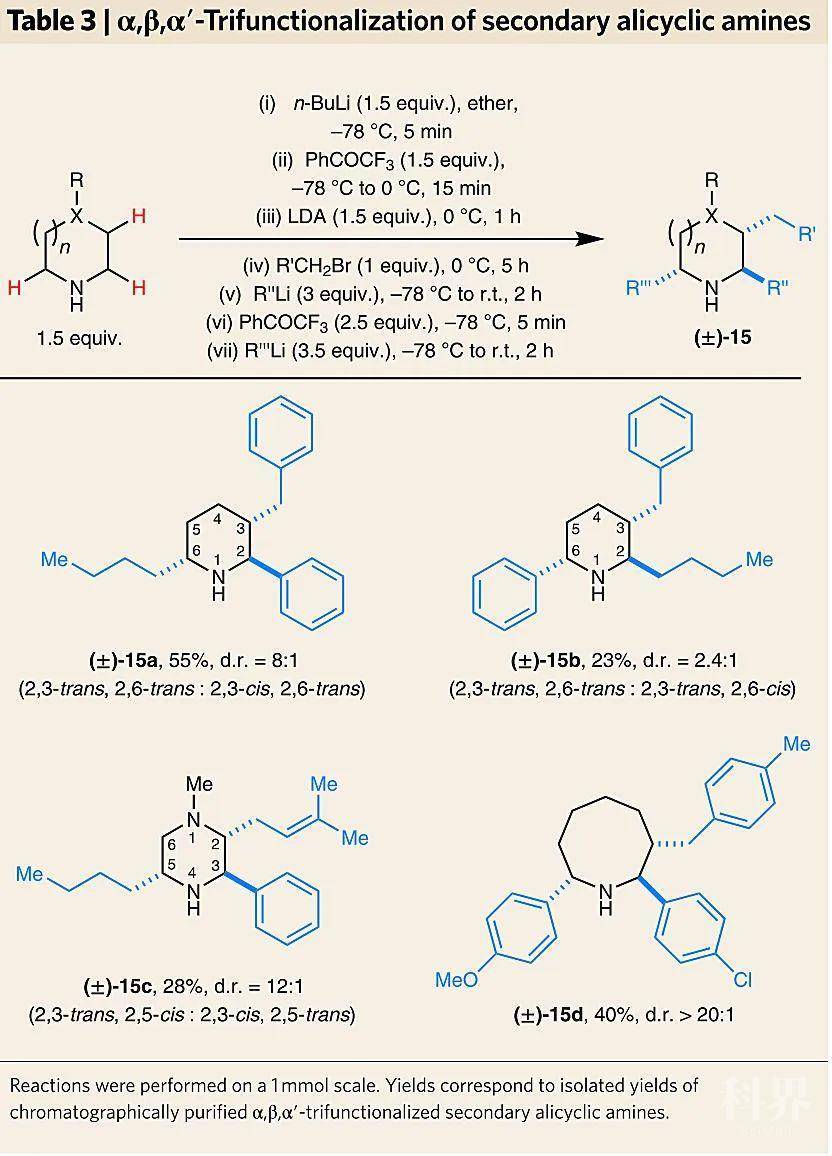
脂环胺的α,β,α′-C-H键三官能团化。图片来源:Nat. Chem.总结Daniel Seidel 教授课题组通过原位生成关键的中间体——环内的1-氮杂烯丙基负离子,首次实现了未保护的二级脂环胺的“一锅煮”β-C-H键官能团化、α,β-C-H键双官能团化和α,β,α′-C-H键三官能团化,为含脂环胺的药物中间体的快速制备提供了有利手段。
原文:Rapid functionalization of multiple C–H bonds in unprotected alicyclic aminesWeijie Chen , Anirudra Paul, Khalil A. Abboud, Daniel SeidelNat. Chem., 2020, DOI: 10.1038/s41557-020-0438-z
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657632874&idx=1&sn=c95ba3efedd63f9f30c52d9efa0ff5f7&chksm=80f86bbab78fe2ac4a757f6bf9f6628352f1251b1e1853e083f19f7e4478e6507d5532bad90e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn