科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-26
来源:iNature
癌症是一种慢性的基因疾病,主要是由正常体细胞发生基因突变而导致。在肿瘤恶性转化和生长的过程中,有一小部分突变会促进促进肿瘤生长和恶性转化,被称为驱动突变(driver mutations);而另一部分对细胞健康无害的突变,被称为乘客突变(passengers)。有关于癌症基因突变的大量研究已为我们提供了很多的信息,从癌症预测,到诊断,再到预后多起到了很大的帮助。但是,人们依旧不清楚哪些突变是功能性癌症的驱动因素。因此,在相关癌症模型中高通量大规模研究这些基因,实现对驱动突变和乘客突变的分类,进一步识别基因组突变的“actionability“(可诉性)是癌症研究最迫切的需求。
现有的体外和体内模型对于确定癌症的生物学特性都有着极佳的效果,但每种模型都有其局限性。其中,基因工程小鼠模型涵盖了肿瘤生长和微环境的变化,但受到量化成本高的限制;基于异种移植的模型在通量小,并且在体外很难操作;肿瘤生长和药物敏感性的研究在很大程度上依赖于体外单层肿瘤模型(2D cell culture),这种模型缺乏许多疾病的特征,如缺氧、细胞间接触的改变和新陈代谢的改变;3D细胞培养缓解了其中的一些担忧,但是想实现高通量仍是一个很大的挑战。开发一种可高通量制备的3D肿瘤模型,以全基因组测序的方式来研究驱动基因的可诉性是迫在眉睫的。
目前3D细胞培养大致分为两类:基于支架的和无支架的。常见的3D细胞培养支架是由细胞外基质形成的水凝胶(Hydrogels),很多3D 类器官都采用水凝胶支架培养。不依赖支架的 3D 细胞培养是指用超低细胞粘附板(通常96孔)、悬滴法、旋转培养法或磁力悬浮法让细胞形成3D球体。该研究以第一种方法为主,优化了甲基纤维素的浓度和接种细胞的密度,更利于3D肿瘤球的形成与生长。

来自美国斯坦福大学医学院的 Michael C. Bassik教授团队在Nature 发表了题目为“CRISPR screens in cancer spheroids identify 3D growth-specific vulnerabilities”的文章,通过可高通量制备的肺癌类器官模型,使用全基因组CRISPR筛查,为我们更进一步解析了2D模型和3D模型之间差异,如突变的频率和驱动基因的富集程度,并建立了在3D肿瘤模型中进行CRISPR筛选来揭示癌症弱点的通用策略。
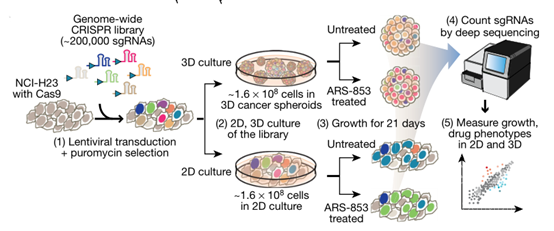
筛选思路(图源自Nature )
在2D肿瘤模型中通过CRISPR筛查已经可以得到丰富的信息,但是他们往往不是复制肿瘤生物学的关键方面,并且在2D培养过程中已知肿瘤抑制基因的表型为阴性。因此,作者以肺腺癌细胞系H23为研究对象,通过调整外基质中甲基纤维素的浓度以及单孔细胞接种密度实现高通量构建3D肺癌肿瘤模型。由于H23细胞本身含有KRAS(G12C)突变,利用CRISPR结合ARS-853(KRAS抑制剂)对2D和3D肺癌肿瘤模型进行筛选,结果表明,3D肺癌肿瘤模型的表型更接近真实癌组织,多为正生长表型,而反观2D模型则多为负表型。
与此同时,对两种模型进行更进一步的通路富集分析,3D肺癌模型以p53和RAS(H23细胞已知的驱动因素)等癌症特异性通路富集为主。2D模型则是以常见的基本细胞功能通路富集为主,如DNA复制。这可能是因为这些驱动基因控制着模型向更具侵略性的3D生长的过渡过程,这是肿瘤发生的标志。其中可能包括与细胞黏附有关的基因或能够响应球体中“类肿瘤”应激(例如缺氧或细胞拥挤)的基因。总而言之,这些数据表明,3D模型能够更准确地捕捉到癌症基因和通路的特征。
为了更系统地比较2D模型、3D模型与肿瘤异种移植模型之间的差异,研究者们建立一个由911个具备生长效应的前体分子构成的sgRNA库,并以此对2D模型、3D模型与肿瘤异种移植模型进行比较。提出了更优的用于体内CRISPR筛选的方案,该方法可以从肿瘤异种移植物中获得了高度可重复的数据。值得注意的是,来自3D模型的基因表型与小鼠异种移植中的基因表型比来自2D模型的基因表型更紧密相关。准确的肿瘤功能缺失表型体外建模可能成为治疗策略个性化的重要手段,例如CREBBP抑制剂已经被用于治疗各种癌症。然而,在这里测试的某些肺癌株中,CREBBP基因敲除对2D癌症模型生长有负面影响,但对3D模型和小鼠异种移植模型的生长有积极影响。
鉴于这类模型表型的基因会因肺癌突变而富集,那么,这些基因中也一定包含了新的治疗靶点。羧肽酶D(CPD)是金属羧酸肽酶家族中特性较差的成员,它能从多肽中裂解C末端精氨酸和赖氨酸,位于反式高尔基网络中。它在2D肿瘤模型中无表现,但是在3D模型中有着明显的表型。CPD的表达与肺癌患者的预后相关,而CPD的缺失可以有效地抑制肿瘤的生长,在3D模型中CPD缺失表现出与KRAS(G12C)抑制剂ARS-853明显的协同效果。与此同时,CPD是通过调节胰岛素样生长因子1受体 (IGF1R)实现其功能的,它可以从IGF1R的α链上去除对其受体活性至关重要的C-末端RKRR基序,从而影响IGF1R的成熟与功能。 这也说明了IGF1R的表达或依赖性,以及KRAS的突变可能作为肺癌靶向CPD和KRAS(G12C)联合治疗的标志物。启发与问题:
1、与2D肿瘤模型相比,3D肿瘤模型中细胞的表型更接近癌基因和肿瘤抑制因子的预期结果,并且与肿瘤异种抑制中的表型更一致。
2、每个癌症样品呈现在研究人员眼前的已经是一个发生了改变的基因组,其中包含着独特且难以预测的诸多点突变、序列的插入缺失、易位、融合以及其他畸变,因而为了能够真正做到全面研究癌症基因组本身所发生的所有突变事件,全基因组测序应被视为肿瘤基因变异研究中 唯一 严谨的方法。
3、能够系统地、大规模地确定肿瘤为响应独特的驱动基因,将有助于改进药物靶点识别模型以及更好地了解癌症的生长。
参考消息:
https://www.nature.com/articles/s41586-020-2099-x
来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247508486&idx=6&sn=376db0f72483ba03f0cfe70ec8678f70&chksm=fce6d1d9cb9158cfd98bb4eacb4221b90d4c87a00b04c240362ad2d326557a4b9045a3dafe77#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Nature亮点丨2D还是3D?癌症研究模型选择需慎重
3D模型确定希克苏鲁伯陨石撞击轨迹
新3D打印模型更有效治疗癌症
中国抗癌协会王瑛秘书长出席河北省肿瘤防治宣传周启动仪式



中国抗癌协会整合肿瘤学分会成立大会在西安召开



新方法构建体外3D神经组织模型

多肽涂层技术突破细胞培养“瓶颈”
“永生”干细胞培养肉诞生

全球首例iPS细胞培养角膜移植成功
3D打印乳腺癌肿瘤模型首现