科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-04
来源:药学进展
专家介绍:吴正红

博士,教授,博士生导师。现任中国药科大学药学实验中心副主任;兼任中国生物颗粒专业委员会委员、南京药剂专业委员会副主任委员;International Journal of Clinical Pharmacology & Toxicology、World Journal of Drug Delivery等多个国外期刊编委及IJP、DDIP、Molecules、JMPR、IJPP、BJMMR等10余个国外期刊评阅人。近5年来,承担和参加国家科研项目12项、省部级5项;授权专利7项,公开12项,产业化1项;在国内外核心期刊合著发表科研论文40余篇;主编与参编教材专著12部;荣获国家、省市及学校教学及科研奖项14次。 主要研究方向:缓控制剂与微粒载药系统。
正文
肿瘤微环境响应型纳米凝胶递药系统的研究进展
[摘要]肿瘤微环境响应型纳米凝胶因其独特的凝胶三维网状结构,同时具备良好的生物相容性、体内循环时间长等特性,使其在纳米药物递送领域受到越来越多的关注。根据不同的肿瘤微环境,主要可分为生物微环境响应型纳米凝胶及物理微环境响应型纳米凝胶2大类。通过对这2大类肿瘤微环境响应型纳米凝胶在药物递送中的研究进展的综述,以期为更精准智能的纳米凝胶递药系统的研发提供参考。
恶性肿瘤由于其旺盛的细胞代谢、分裂与增殖失控的特性,其生理特征与正常细胞显著不同,主要体现在弱酸性、高还原性、低氧及某些特异性酶过度表达等方面。肿瘤组织这些特殊的微环境为研究靶向性更强、毒副作用更小的治疗药物提供了新的思路。过去的几十年里,在肿瘤药物递送系统中,纳米技术作出了重大的贡献,而纳米凝胶比其他常规纳米载体显示出更高的稳定性。纳米凝胶是纳米级别凝胶颗粒,存在三维溶胀的聚合物链交联网络,药物包载于其中可以有效避免酶降解。其具备水凝胶的高含水量,可根据外界环境变化收缩或膨胀,和纳米粒子的被动靶向性以及有较长的血液循环时间等特点。因而用纳米凝胶为载体递送抗肿瘤药物有着良好的前景。基于肿瘤细胞独特的微环境和纳米凝胶的优点,设计肿瘤微环境响应的纳米凝胶,使其具备pH、活性氧、还原敏感以及酶、温度及光热响应等特点。本文从不同的划分角度将肿瘤微环境响应的纳米凝胶分为生物环境响应型、物理环境响应型两大类,并在此基础上进行细化,综述了近几年在这方面的研究进展。
1生物环境响应型纳米凝胶
根据肿瘤细胞微环境的独特性,将pH刺激响应凝胶、还原响应凝胶、活性氧刺激响应凝胶、酶响应凝胶统一划分为生物环境响应型纳米凝胶。
1.1pH刺激响应型纳米凝胶
肿瘤细胞新陈代谢过快导致其分泌酸液过多,致使肿瘤细胞的pH值低于正常组织和血液。血浆pH值(pH7.4)与肿瘤细胞外微环境(pH6.5~7.2),以及溶酶体(pH4.5~5.5)与内涵体(pH5.5~6.8)的pH值之间的显著差异更是提供了良好的药物释放触发条件。
而制备酸响应纳米凝胶的策略之一是在聚合物主链中通过酸不稳定官能团交联药物。这些纳米凝胶降解的触发基于pH降低时纳米凝胶网络内酸不稳定键的断裂,比如腙键、酰胺键和原酸酯键。包封的药物的释放由纳米凝胶在低pH下的快速降解产生。不同酸敏感基团可在不同pH环境中断裂,使得药物在肿瘤细胞外液或溶酶体、内涵体中释放发挥不同疗效[1,6-7]。pH响应纳米凝胶的另一个策略是酸性侧链和(或)主链的官能团形成交联聚电解质的聚合物。这些基团在高于聚合物网络的pKa的pH下电离。由于存在电离基团的静电排斥,水凝胶链状结构延伸,增加吸水量体积膨胀。
1.1.1肿瘤胞外微环境响应肿瘤组织代谢产生酸性副产物以及与细胞酸清除受损的高糖酵解活性的组合使得肿瘤胞外微环境pH值达到6.5~7.2。与正常细胞和血液环境(pH7.4)相比,这种较低的肿瘤细胞外pH值已被用于促进肿瘤细胞摄取药物以及促进抗癌靶向药物的释放。Du等制备了一种pH响应电荷转换的纳米凝胶,并分别测定了包载牛血清白蛋白(bovine serum albumin,BSA)和阿霉素(doxorubicin,DOX)的凝胶体外细胞内的释放量。实验结果表明在pH=6.8条件下,由于酸响应使得酰胺键迅速断裂释放出BSA。只需要0.5h即可释放包载量80%的BSA,并且酸响应导致的电荷转换促进了肿瘤细胞对凝胶的胞吞。Oh等将聚乙二醇壳聚糖接枝形成3-二乙氨基丙基(3-diethylaminopropyl,DEAP),在生理pH值下,自组装制备成pH响应的纳米凝胶,当pH值降低至肿瘤细胞外的pH值(pH=6.8)时,由于DEAP的质子化作用,纳米凝胶结构改变并从其中迅速释放DOX,从而提高DOX治疗效果。张滢等用丙烯酸改性的葡聚糖作为交联剂,与甲基丙烯酸二甲氨基乙酯反应得到葡聚糖纳米凝胶。该纳米凝胶能够在生理pH条件下保持较小粒径,有利于体循环,而在肿瘤微酸性环境刺激下触发粒子膨胀,粒径增大从而促进细胞内吞实现增加胞内释药的目的。
1.1.2肿瘤细胞内涵体/溶酶体微环境响应溶酶体为内部呈酸性环境(pH4.5~5.5)并含有多种水解酶的细胞内细胞器,其在细胞膜修复、病原体防御、自噬和信号传递以及胞内药物释放中起关键作用。肿瘤细胞中的溶酶体比正常组织细胞中的溶酶体更多且体积更大。内涵体(pH5.5~6.8)是细胞内的一个泡状细胞器,当细胞连同自身的部分细胞膜内吞入一个物质(可以是病毒、蛋白等)时就会产生这样的内涵体。它存在于细胞质中,但它内部的物质可以通过细胞特有的运输系统向细胞核内传递信号。而响应性纳米凝胶制剂通常通过内吞作用被肿瘤细胞内化,借助内涵体/溶酶体的低pH环境则能够实现细胞内的药物释放。然而,应该注意的是,所有细胞(肿瘤细胞或正常细胞)的内涵体和溶酶体都是酸性的,这需要高肿瘤靶向性和选择性肿瘤细胞摄取以防止药物潜在的副作用。
Ju等制备了在不同pH条件下,体积可膨胀-收缩可逆的纳米凝胶载体系统。其由具有聚电解质核心和交联蛋白质壳的全生物聚合物基纳米凝胶组成,并将其用于DOX的递送研究。通过自由基聚合反应,聚N-异丙基丙烯酰胺,N-赖氨酸-N'琥珀酰基壳聚糖(N-lysinal-N'-succinyl chitosan,NLSC)与N-N'亚甲基双丙烯酰胺形成聚电解质内核,外层吸附BSA形成性质稳定的纳米凝胶。在溶酶体酸性条件下,NLSC的氨基基团质子化,产生静电排斥,纳米凝胶高度膨胀,药物得以释放;同时溶酶体胀裂,纳米凝胶进入细胞质。而胞质中pH较高,载体体积收缩回原始大小,且可进入相邻的肿瘤细胞发挥作用。该药物载体系统可以深入渗透到肿瘤组织中,增加药物的疗效。
Seyfoori等通过结合多壁碳纳米管(carbon nanotube,CNT)和pH敏感纳米凝胶的优点,开发了多功能磁/pH响应纳米混合系统,包载DOX作为一般癌症化学治疗药物模型。将壳聚糖纳米凝胶涂覆在MnFe2O4磁性纳米颗粒的表面上,随后将它们沉积在官能团化CNT的表面上以形成共价键合的pH/磁响应CNT。分析纳米载体的性质,载药效率以及药物释放特性,发现官能团化的CNT有着溶酶体微酸环境响应(pH5.3)的特点。通过在不同时间间隔暴露于DOX释放上清液的U-87胶质母细胞瘤细胞系的活/死测定,证明壳聚糖涂覆的磁性纳米复合材料可以在一周内产生更高的pH响应性和更高的药物释放。这种基于肿瘤微环境响应的纳米载体载药量更高同时也更加智能。Julio等通过沉淀/分散聚合法合成了具有不同N-异丙基丙烯酰胺/丙烯酸摩尔组成的聚(N-异丙基丙烯酰胺-共-丙烯酸)纳米凝胶(nanogel,NG)作为药物递送系统(drug delivery system,DDS)并以盐酸阿霉素为模型药物。动态光散射(dynamic light scattering,DLS)显示,在模拟生理学环境条件下,NG有良好的生物分散性。
此外,由于阳离子药物与阴离子NG的离子相互作用,NG显示出较高的药物负载能力和效率。在37℃下的等离子体模拟培养基(pH=7.4和0.14mol·L-1NaCl)下的药物泄漏最小,在溶酶体环境模拟培养基(pH=5和0.14mol·L-1NaCl)下触发药物释放。
然而由于内涵体/溶酶体中存在大量水解酶,为了避免包载的小分子药物、基因药物、蛋白质在内涵体/溶酶体中释放后被水解,如何借助在溶酶体膜上形成孔洞、质子海绵效应等机制增强其溶酶体逃逸依旧是一个非常值得研究的问题。
1.2还原响应型纳米凝胶
肿瘤细胞内的谷胱甘肽(glutathione,GSH)浓度是正常细胞的7~10倍,而在正常细胞内的GSH浓度又是细胞外的GSH浓度的200倍,因而肿瘤细胞内是一个高还原性的环境。氧化还原响应型纳米凝胶具有优异的药物负载能力;通过增强的渗透性和保留效应(enhanced permeability and retention effect,EPR)在肿瘤组织中的选择性积累;可调节和稳定的化学和物理结构和细胞内还原条件下的快速药物释放等特点。大多数氧化还原响应的纳米凝胶具有二硫键、琥珀酰亚胺-硫醚键等组分。
Tian等制备了由透明质酸(hyaluronic acid,HA)交联了聚(乙二醇)二缩水甘油醚和胱胺(cystamine,CYS)形成的凝胶。CYS中的二硫键提供还原响应特性,凝胶中负载的DOX得以迅速释放;而二硫键断裂的同时纳米凝胶尺寸显著性增加从而损害了肌动蛋白丝并进一步阻止其在胞质内的扩散和组装,致使肿瘤细胞凋亡增强。这种综合了生理刺激触发的物理治疗和药物治疗的方式也为恶性肿瘤的治疗提供了新的思路。He等采用L-胱氨酸交联制备甲氧基聚(乙二醇)(methoxy poly(ethylene glycol),mPEG)-聚(L-苯丙氨酸-共-L-胱氨酸)纳米凝胶。通过以氨基封端的mPEG(mPEG-NH2)作为大分子引发剂,L-苯丙氨酸N-羧酸酐(L-phenylalanine N-carboxy anhydride,LPNCA)与L-胱氨酸N-羧酸酐(L-cystine N-carboxy anhydride,LCNCA)一步开环聚合(ring opening polymerization,ROP)形成凝胶。该多肽凝胶包载DOX用于智能治疗前列腺癌(prostate cancer,PCa)。实验结果表明,标记为NG/DOX的负载纳米凝胶显示出GSH诱导的凝胶肿胀和加速DOX释放的效果。随后,NG/DOX显示出有效的细胞内摄取和肿瘤细胞增殖抑制特性。此外,NG/DOX在体内RM-1PCa移植小鼠模型中具有增强的抗肿瘤效力和安全性,表明其具有巨大的临床治疗潜力。
同样地,结合肿瘤微环境的特点,还原响应常与pH响应相结合,从而更好的对药物的释放速度和释放位点进行调控。徐杰等制备了包载DOX具有pH和还原性双响应的黄原胶纳米凝胶。以胱胺四酰肼做交联剂,通过“一步法”与黄原胶反应。凝胶中的游离酰肼基团与DOX的酮羰基反应生成酸敏感的酰腙键,使得DOX在到达肿瘤部位后迅速释放;而胱胺四酰肼中的二硫键则在高GSH环境下断裂,破坏了凝胶的交联结构,同样促进DOX的快速释放。
1.3活性氧刺激响应型纳米凝胶
活性氧(reactive oxygen species,ROS)主要包括O2-、H2O2以及HO-。其通常由线粒体电子传递和副产物产生,被用于正常细胞的细胞信号传导。在体内各种抗氧化酶的作用下,ROS水平维持稳态。由于肿瘤细胞的增殖失控,其组织中血管尚未发育成熟,使得肿瘤组织处于缺氧状态。肿瘤细胞的缺氧导致其组织内ROS浓度大于正常组织。因而靶向肿瘤细胞并具备ROS响应的药物递送材料得以运用。代表性材料如硫醚和含硒聚合物,该类材料能在氧化条件下转变为亲水基团从而发挥作用。目前,关于ROS刺激响应型的纳米药物、微球以及聚合物研究较为成熟,而ROS刺激响应型的纳米凝胶研究则相对较少。
Chen等通过硫醇-烯点击反应设计并合成了一种pH和ROS双响应纳米凝胶,以DOX作为抗癌模型药物。在有机碱催化剂存在下,3种单体之间在“一锅”中进行共聚合,使用二丙烯酸酮作为酸不稳定接头(A2单体),3-巯基丙酸酯是交联单元(B4单体)。同时,mPEG-丙烯酸酯作为大分子单体,赋予纳米凝胶良好的水分散性。得到的硫醚基团可被氧化成更亲水的链段,有利于加速缩酮键的水解。通过1H-NMR和尼罗红释放实验验证了纳米凝胶的pH响应和H2O2氧化作用响应。Zhang等制备了一种ROS响应型PEG化的多聚磷酸酯纳米凝胶。多聚磷酸酯是活细胞中不可或缺的一部分,有良好的生物相容性,其与PEG的交联结构赋予凝胶良好的稳定性;而该纳米凝胶具备硒化物基团使其能响应肿瘤细胞中较高浓度的H2O2,疏水的硒化物基团被氧化成亲水性硒酮基团,诱导纳米凝胶迅速溶胀从而使其包载在其中的抗癌药物能够有效释放。
1.4酶响应型纳米凝胶
在肿瘤细胞部位,有许多酶(例如蛋白水解酶,透明质酸酶,脂肪酶,基质金属蛋白酶和纤溶酶)表达增加。肿瘤细胞外环境中这些过表达的酶具有很强的吸引力,可以改善肿瘤细胞摄取,肿瘤组织的溶出和/或药物释放。因而利用酶响应设计制备纳米凝胶也是研究的热点,其原理是在具有一定选择性催化酶存在的条件下,利用局部酶的表达来触发药物递送系统,而在不存在特定酶的情况下纳米凝胶非常稳定。酶介导的纳米凝胶递送系统可以响应肿瘤细胞外的酶环境,比如基质金属蛋白酶、透明质酸酶等。
1.4.1基质金属蛋白酶响应型纳米凝胶基质金属蛋白酶(matrix metalloproteinase,MMP)是具有约24种人类内肽酶的家族,其共同起作用以降解许多蛋白质的组分,包括细胞外基质,MMP也称基质蛋白。MMP尤其是MMP-2和MMP-9参与许多癌症的侵袭、浸润和转移。Terada等最先利用MMP-2特异性靶向肿瘤细胞,将其与PEG化的脂质体结合,利用酶特异切割作用使脂质体被肿瘤细胞吸收。具有PEG涂层在生理条件下能够保护有效负载,稳定纳米凝胶,但是PEG链束缚在表面上会降低肿瘤细胞对凝胶的摄取,导致治疗效果降低,这就是所谓的“PEG困境”。为了解决这一问题,Choi等在制备PEG包覆的多层纳米凝胶时,在PEG层与纳米凝胶层引入MMP-2可切割的肽接头GPQGIWGQ,利用了肿瘤细胞外高表达的MMP-2将其裂解,从而改善纳米凝胶的选择性细胞内摄取。
Gordon等利用肿瘤细胞外增加的MMP-9浓度来诱导纳米凝胶的表面转换特性,在凝胶结构上修饰MMP-9可切割的PEG肽缀合物mPEG(350)-GPLG↓LLGC(NH2),如图1所示。MMP-9水解底物除去PEG屏蔽以显示来自N-末端的多胺类表面。由于电荷转换,空间稳定性降低使膜相互作用增强,提高了肿瘤细胞对凝胶的摄取。进入胞内在GSH刺激下,凝胶结构中二硫键断裂从而药物在胞内快速释放。该凝胶能够在MMP-9存在下将其表面特性从被动聚乙二醇化颗粒转化为活性胺修饰的颗粒。HeLa细胞的共聚焦显微镜图像显示mPEG350-NG的MMP-9“活化”后比未经修饰的mPEG350-NG有更大的细胞摄取,表明该纳米凝胶能响应癌症相关蛋白酶实现刺激响应摄取。
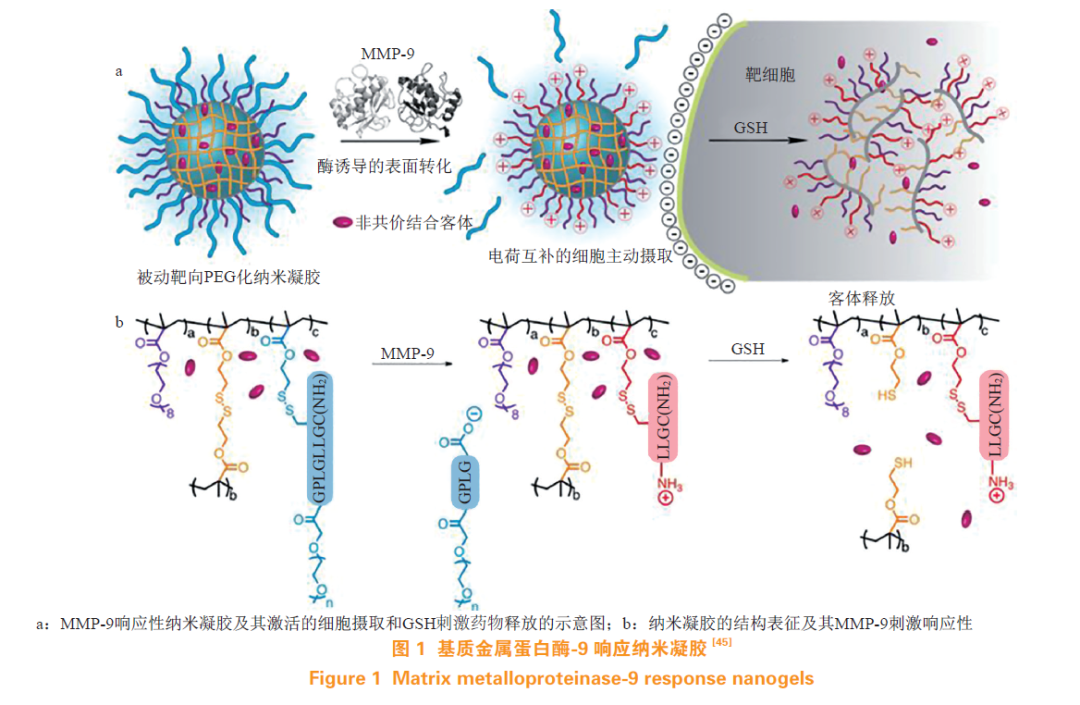
1.4.2透明质酸酶响应型纳米凝胶透明质酸(hyaluronic acid,HA)是一种酸性黏多糖,其广泛分布于人体内,尤其是在结缔组织和上皮组织中。而透明质酸酶(hyaluronidase,HAase)则是用于降解HA的酶家族。在乳腺癌、脑癌和膀胱癌中,HAase的表达增加。Yang等通过甲基丙烯酸化策略制备含有酶敏感基团的HA载DOX纳米凝胶,在脂肪酶和透明质酸酶的作用下纳米凝胶可以解交联。在2D单层细胞模型和3D多细胞球状体中,HA凝胶作为药物载体显示出受体依赖性的细胞摄取和渗透;近红外(near infrared,NIR)荧光成像实验显示纳米凝胶可以显著靶向肿瘤区域;体内生物分布研究证明,与游离DOX相比,HA载DOX纳米凝胶增加了DOX在肿瘤部位的积累,延长了DOX的循环时间。在H22荷瘤小鼠模型上,该纳米凝胶表现出优秀的抗肿瘤效果。这种靶向、生物相容和多酶可降解的HA纳米凝胶在癌症治疗的药物递送中具有巨大潜力。
2物理环境响应型纳米凝胶
2.1温度响应型纳米凝胶
通常温度响应常与其他刺激响应联合使用。具有温度响应的化合物,其分子结构通常含有酰胺、醚键和羟基等官能团。代表性化合物如聚(N-异丙基丙烯酰胺)(poly(N-isopropylacrylamide),PNIPAM)、聚N,N-二乙基丙烯酰胺、聚N-乙烯基己内酰胺、聚甲基丙烯酸N,N-二甲氨基乙酯、聚环氧乙烷和聚乙烯吡咯烷酮等。利用具备温敏特性的化合物制备的纳米凝胶能够通过快速的体积改变对外界温度变化作出响应,在特定的温度下发生非连续体积相转变,这一温度被称为低临界溶解温度(low critical solution temperature,LCST)。当温度低于LCST时,水凝胶处于溶胀状态;当高于该温度时,水凝胶迅速失水收缩,从而显示出对温度的响应性。最常用的温敏型化合物是PNIPAM,未经修饰的PNIPAM在纯水中的LCST为32℃,与人体体温相近。经过适当的修饰,可使其LCST改变。
Xiong等制备了双温/pH敏感的聚N-异丙基丙烯酰胺-共-丙烯酸(poly(N-isopropylacrylamide-co-acrylic acid),PNA)纳米凝胶并将其作为DOX载体。PNA纳米凝胶LCST受pH值影响,在pH7.4时高于50℃,在pH5.3时为41℃,pH6.8时43℃。在生理条件下凝胶是亲水的,但在温度高于其LCST时且正常组织之间存在的pH差异使其经历双温度/pH诱导的相变,该特征可让肿瘤细胞选择性地摄取DOX-PNA纳米凝胶,有利于在区域高温治疗下的肿瘤细胞内化。抗肿瘤药物DOX通过酸不稳定键与PNA共价结合,肿瘤细胞酸性触发时裂解释放其有效负载。DOX-PNA纳米凝胶能够改善肿瘤靶向给药,减少副作用,在高温和化疗联合治疗中有很大的应用价值。Jiang等制备了Cy5.5标记的乳铁蛋白(lactoferrin,Lf)结合的pH/温度敏感磁性(Cy5.5-Lf-MPNA)纳米凝胶。由于其pH和温度敏感性,在生理条件下,Cy5.5-Lf-MPNA凝胶亲水溶胀,延长了血液循环时间;在微酸环境下,疏水收缩使得凝胶更容易在肿瘤组织中积累并被内化。此外乳铁蛋白是胶质瘤的有效靶向配体,提供活性肿瘤靶向的能力。在荷有原位胶质瘤的大鼠中进行的体内研究结果表明,使用Cy5.5-Lf-MPNA凝胶作为造影剂,能够获得高灵敏度和特异性的荧光成像。生物相容性实验结果表明其具有良好的生物相容性。该凝胶可用于细胞毒性检测和组织病理学分析,有望成为临床脑胶质瘤的造影剂。
2.2光热响应型纳米凝胶
由于在肿瘤药物靶向治疗过程中,出现了多药耐药性(multidrug resistance,MDR)的问题。因此,近几年来化学药物治疗联合其他治疗手段通常可用来提高抗肿瘤药物的治疗效果。高温对肿瘤有一定的杀伤力且部分化疗药物有热增敏效应,因而光热治疗是近几年肿瘤纳米治疗研究的前沿和热点。光热治疗主要是利用光热纳米材料的被动或主动靶向性以及其在光照条件下能够实现对肿瘤部位有选择性的加热,导致肿瘤细胞内部温度过高,从而抑制肿瘤细胞的分裂或杀死肿瘤细胞;或者通过光热效应控制抗癌药物从纳米载体释放,以及提高细胞膜的通透性,实现化学-光热组合治疗。常见的光热纳米材料主要有无机非金属材料,如碳、硫化铜等;贵金属纳米材料,如金、钯等;有机小分子材料,如吲哚菁绿(indocyanine green,ICG)等;有机高分子材料,如聚苯胺、聚吡咯、聚多巴胺等。
Chen等制备了一种能够有效克服主要由药物外排转运蛋白(drug efflux transporter,DET)引起的肿瘤细胞多药耐药性的凝胶。受到“特洛伊木马”设计的启发,利用生物相容性甲氧基聚(乙二醇)5k-嵌段聚(L-谷氨酸钠盐)200(PEG-PLE)、绿色荧光有机硅纳米点(fluorescent silicone nanodots,OSiND)和可光降解的吲哚菁绿(ICG)这三个功能组件的简单超分子自组装制备了载DOX光控纳米凝胶(SiPING)。SiPING作为一种多功能纳米平台能够有效克服MDR的“特洛伊木马”的作用基于以下两步法:第一步,由于DET的存在,质膜起到细胞的门的作用让抗癌“士兵”(DOX)本身很难跨越。“士兵”通过隐藏在具有适当表面涂层(PEG-PLE)的“特洛伊木马”纳米凝胶内部以逃避DET的识别,借助小窝蛋白、网格蛋白和巨噬细胞介导的胞吞途径转运到耐药细胞内,众多的“士兵”广泛分布在细胞质中,有助于细胞核附近形成局部高浓度,成为进一步将它们输送到细胞核中的先决条件。第二步,利用光触发使纳米凝胶分解,大量“士兵”从凝胶中释放进入细胞核。长循环PEG-PLE防止纳米凝胶被质膜上的DET识别,以增加纳米凝胶的肿瘤和细胞积累效率,可光降解的ICG赋予凝胶可光活化可拆卸的光控制药物释放,以及荧光OSiND作为桥接交联其他两种组分和作为探针进行生物成像。Chen等用α环糊精和偶氮苯官能团化的透明质酸、金纳米双环酰胺(gold nanobipyramid,AuNB)缀合的介孔二氧化硅纳米粒子(mesoporous silica nanoparticle,MSN)制备了可注射光响应可持续癌症治疗的纳米凝胶药物递送系统。由于HA对MSN和在肿瘤细胞上过表达的CD44受体之间的特异性亲和力,MSN可以选择性地附着于肿瘤细胞。利用α-环糊精和偶氮苯之间的热响应相互作用以及AuNB的光热性质,在近红外(NIR)辐射下原位自组装成水凝胶。凝胶化后,载有药物(DOX)的MSN载体封闭在水凝胶的HA网络中,而由于肿瘤组织周围透明质酸酶(HAase)的上调,水凝胶中HA的进一步降解将释放来自水凝胶的MSN,然后可被肿瘤细胞摄取并将其药物递送至细胞核。该纳米凝胶在肿瘤组织及其周围提供了富含DOX的微环境,能够实现持续长时间的释药,既整合了肿瘤组织化学疗法和光热疗法的优势,又具备酶响应的特点。
光热治疗是在外部光源照射下实现肿瘤热杀伤的一种治疗手段,但热疗温度过高则不利于药物的递送,温和热疗才能使化疗药物发挥最大的热增敏作用。而温度则是温敏给药系统中的关键因素,如果能够将光热纳米材料与温敏材料相结合制备出温度可调控的药物释放系统,就能够达到联合抗肿瘤、减少药物使用剂量、降低系统毒性的效果。
3展望
为了满足更精准智能的实现肿瘤组织内药物递送,改善多药耐药问题,科研人员在肿瘤微环境响应方面作出了坚持不懈的努力。而具备粒径小、血液循环时间长、生物相容性好、生物可降解、载药量高等优点的纳米凝胶在单一肿瘤微环境响应和多重微环境响应方面仍然有很大的发展和优化的空间。制备响应可逆性强、响应灵敏度高、多重环境响应相结合的纳米凝胶将会是未来研究的主要方向。
来源:ppsyxjz 药学进展
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651308741&idx=1&sn=46faf77575552f6af984d502c565e3df&chksm=8bf494c9bc831ddf2e9d05018ee639982926caaadfb6f9bea47be38c032407496103589aba40&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
癌症 肿瘤 肿瘤细胞 纳米 纳米粒子 药品 纳米效应 交联反应 溶酶体

《Science》荐读:纳米粒子唤醒免疫细胞对抗癌症
载药的纳米粒子可搜寻并摧毁癌症干细胞
【新科技知识干部读本】海洋药物研究有利于新药研发

纳米粒子孔径调节为免疫激活和癌症治疗提供新思路
新法使用磁性纳米粒子治疗癌症
新型纳米粒子可对放射治疗产生反应以从内部杀死癌症

俄发现有助诊治癌症的纳米粒子
夏季太阳毒,小心“日光性皮炎”!

硅纳米粒子有助“曝光”肿瘤集聚区
《AFM》:伪装者,癌细胞膜修饰的明胶纳米粒子用于肿瘤的个性化治疗