科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-10
来源:iNature
自噬(Autophagy),是真核细胞中高度保守的生命代谢过程。顾名思义自噬是细胞通过“自己吃自己”来维持必须的生命活动,自噬负责将受损的细胞器、错误折叠的蛋白及其他大分子物质等运送至溶酶体降解并再利用。从1963年发现自噬至今已经60多年,人们逐步弄清楚了自噬发生到降解所需的主要分子机器。并且发现自噬广泛的参与到了生命活动的各个反面,从生长发育到机体衰老1,从正常代谢到各种疾病等2。由于自噬的广泛影响,日本科学家大隅良典也因“对细胞自噬机制的发现”独自夺得2016年度的诺贝尔生理学或医学奖3。即使如此,自噬领域仍然存在一系列悬而未决的问题等待探索。
自噬主要是由一系列的膜结构相关的动态过程组成。自噬起始阶段,自噬的核心分子或被招募到内质网的一个伸出的膜结构-内质网出口位点(ER Exit Site-ERES ),在该位置形成一个独立的月牙形的膜结构(Isolation Membrane), 在自噬分子机器的帮助下,IM进一步的延伸,扩大,包裹内容物,形成未闭合的自噬前体(Phagophore),并最终闭合膜结构形成双层膜结构的包含待降解内容物的自噬体(autophagosome)4。这一系列过程都需要自噬体膜结构招募磷脂,来逐渐扩大膜结构,早期人们一直认为细胞中现有的膜结构是主要的磷脂来源,自噬分子机器通过不停的吸收和转运细胞膜、内质网、高尔基体、线粒体等膜性细胞器的磷脂,来形成自噬体膜结构5。但是该观点在很多方面也受到质疑,比如自噬发生时,细胞内膜结构会明显增多,仅仅依靠现有的膜结构作为磷脂来源一定程度上很难满足自噬过程对磷脂的需要。其次,自噬发生时,相比于直接新合成磷脂,转运磷脂需要更多的蛋白等调控因子参与其中,且速率得不到保证,不是一个最经济的途径。
人们一直怀疑在利用现有磷脂的基础上,或许自噬过程还有一套直接新生成磷脂的方式来满足自噬体膜结构对磷脂的需求。2020年1月,德国马克斯-普朗克研究所(Max Planck Institute, MPI)的Martin Graef课题组给出了全新的答案。该课题组发表于Cell 的研究论文:Local Fatty Acid Channeling into PhospholipidSynthesis Drives Phagophore Expansion during Autophagy以酵母作为主要的模式生物,筛选并鉴定了一批乙酰辅酶A合成酶(ACS),提出并验证了ACS帮助下的磷脂合成过程是自噬磷脂的重要来源6,解决了自噬领域长期悬而未决的问题。

得益于酵母简单的遗传操作手段,方便的显微镜观察方式,作者利用酵母作为模式生物,分别将酵母中的最主要的四种ACS进行绿色荧光标记,在活细胞状态下下检测四种ACS与自噬体标记物Atg8在酵母中的共定位情况,结果显示四种ACS中,Faa1和Faa4在自噬条件下与自噬体高度共定位,Faa3和Fat1的定位则相对较弱。活细胞序列成像结果显示ACS在ATG8信号出现后约1分钟就被招募到自噬体上,且动态参与到自噬体形成的整个过程,直到外膜的ATG8因为自噬体成熟脱落后还存在与自噬体上,这些结果提示ACS参与到了自噬体的合成过程。
考虑到磷脂合成过程对细胞的生命活动影响不仅仅在于自噬过程,还对细胞的脂质代谢和信号传导具有重要作用,作者在构建基因编辑模型来验证ACS在自噬过程中的功能时,利用了异位表达的体系,即先敲除某一个基因,然后表达一个带强制定位到其他膜结构(此处为细胞膜PM)的异位标签融合该表达,从而保证在不影响ACS在细胞中的其他功能的情况下,研究ACS不能定位到自噬体对自噬过程的影响。这里通过共敲除Faa1和Faa3两个ACS,并异位表达不能上自噬体的Faa1蛋白,同时抑制酵母中特异的额外的磷脂合成途径,来模拟细胞内磷脂合成正常,但是自噬体附近的磷脂合成受阻(PM-FAA1)的条件。结果显示该条件下细胞内的Atg8剪切受阻,显示自噬过程被严重抑制,表型类似于Atg7的敲除,电镜下显示该条件下自噬体形成受阻,数量上显著少于野生型,证明位于自噬体附近的磷脂合成过程对于自噬的进行必不可少。
为了探究Faa1的定位位置及表达强度对于自噬体形成的影响,作者分别构建了定位于液泡胞浆面的Faa1,定位于ER的低表达和高表达的Faa1,以及定位于自噬体起始位点ERES的融合Faa1。为了探究Faa1的催化活性对自噬的影响,作者构建了失活的Faa1Y269A,Faa1E460A和Faa1W533A。在荧光显微镜下,不同定位模式的Faa1均能按照设计定位于不同的细胞器,失活的突变体的定位则不受影响。Western Blot显示,失活的突变体影响了自噬的正常进行,同时,定位于其他细胞器的Faa1也影响了Faa1的正常功能。这些数据证明,Faa1的正常定位和正常催化活性对于Faa1对自噬的调控都是必须的。
更进一步,通过在活细胞显微镜下观察比较野生型细胞和PM-FAA1的自噬体形成过程,作者发现自噬体附近的磷脂合成受阻影响了自噬体的生成扩张过程,野生型细胞能够生成环形的完整自噬体,而PM-FAA1则只能观察到自噬的起始,却不能够正常扩大和成熟。通过利用标记的自噬底物preApe1,以及对荧光显微镜结果的定量统计,发现自噬体的扩张和内容物的包被过程受到了影响,PM-FAA1细胞中自噬体不能正常的扩张和包被。证明Faa1影响了自噬体生成过程的扩张阶段。
更重要的是,为了探究ACS对自噬体膜成分的影响,作者对酵母中的自噬体膜进行分离,并进行了磷脂组学的质谱研究,通过分析不同条件下的自噬体膜成分组成,发现在PM-FAA1细胞中,ACS不影响细胞其他组分膜成分,也不影响总体膜成分组成的,但是会以影响新生成的磷脂进入自噬体的方式影响自噬体的磷脂膜组分的扩张和更新,从而影响自噬。这些结果一方面证明了自噬过程是需要磷脂合成途径合成新的磷脂,另一方面证明Faa1对自噬的影响是通过影响磷脂的合成进行的。
结合以上数据,作者总结了以下的模式图,Faa1作为经典的COPII 和Atg9介导的磷脂来源的补充,参与到了自噬体形成过程当中,作为磷脂的一个重要来源。Faa1通过在自噬体附近的定位,催化脂肪酸,作为磷脂合成的上游反应,调控磷脂的合成,新合成的磷脂再通过经典的Atg2/Atg18磷脂转运途径,转运到自噬体上,参与自噬体的形成和扩张。
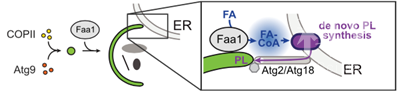
文章模式图(图源自Cell )
综上所述,该文章从ACS入手,分析了磷脂合成途径对于自噬体膜成分的重要性,证明了磷脂合成途径是自噬生成自噬体膜的重要磷脂来源,补充了早期关于自噬体膜来源于细胞内膜性细胞器的假说,也为自噬调控方面的基础和临床研究提供了新的方式和靶点。
参考消息:
1. Rubinsztein,D. C., Mariño, G. & Kroemer, G. Autophagy and aging. Cell 146, 682-695(2011).
2.Rabinowitz,J. D. & White, E. Autophagy and metabolism. Science330, 1344-1348(2010).
3.Levine,B. & Klionsky, D. J. Autophagy wins the 2016 Nobel Prize in Physiology orMedicine: Breakthroughs in baker's yeast fuel advances in biomedical research. Proceedings of the National Academy ofSciences 114, 201-205 (2017).
4.Levine,B. Autophagy and cancer. Nature 446, 745-747, doi:10.1038/446745a(2007).
5.Tooze,S. A. & Yoshimori, T. The origin of the autophagosomal membrane. Nature Cell Biology 12, 831-835, doi:10.1038/ncb0910-831 (2010).
6.Schütter,M., Giavalisco, P., Brodesser, S. & Graef, M. Local fatty acid channelinginto phospholipid synthesis drives phagophore expansion during autophagy. Cell 180, 135-149. e114 (2020).
来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247508747&idx=6&sn=40468f7d7f5242a831aeb5c7e94a731a&chksm=fce6d0d4cb9159c23636710a7defac22c940f478e97c7c6844ff69f526a4dee03c156beea84c#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Cell:全基因组筛选揭秘内质网自噬分子调控机制

Cell丨自噬如何减少脑中异常β淀粉样蛋白沉积?
【学术前沿】Cell/Cell Res | 清华大学葛亮团队发现自噬体生物发生的重要调节新机制
张力膜结构

少吃是关键!中国科学家发现长寿机制

昆明动物所等在百岁老人健康长寿保护机制研究中取得进展----中国科学院

复旦大学鉴定出4种自噬体连接化合物有望治疗亨廷顿舞蹈病等polyQ疾病
饥饿应激状态中核糖体通过蛋白酶体途径而不是核糖体自噬重塑蛋白质组

潘李锋组揭示自噬相关SNARE蛋白介导自噬体-溶酶体融合的分子机制
膜结构