来源:BioArt
细胞发生饥饿应激时通过蛋白酶体和自噬系统启动蛋白降解机制,以及同时抑制蛋白翻译重新配置细胞蛋白质组。其中核糖体是该反应的主要靶标,核糖体负责翻译并在饥饿应激期间会被溶酶体降解
【1】。核糖体蛋白
(ribosomal (r)-proteins)的细胞丰度很高,约占蛋白质组的6%,其中精氨酸和赖氨酸含量较高。这样的特性会自然而然得出假设,在饥饿应激期间通过自噬途径,将r-蛋白作为碱性氨基酸的营养来源。
r-蛋白受翻译和组装机制以及蛋白酶体降解调控,而自噬可促进核糖体的更新。此前的研究关于氨基酸饥饿或mTOR抑制对细胞中r-蛋白稳态的调控主要集中于自噬对r-蛋白更新的影响。由于自噬只是核糖体稳态调控的途径之一,因此尚缺乏关于细胞如何在饥饿应激下调节核糖体丰度的全面研究。而且在急性饥饿应激反应过程中对r-蛋白翻译和降解机制还知之甚少。在特定条件下,r-蛋白质被用作氨基酸来源的程度尚不清楚。
近日,来自美国哈佛大学J. Wade Harper团队在Nature上发表了
Systematic quantitative analysis of ribosome inventory during nutrient stress的文章。本研究
通过一系列定量蛋白组学以及翻译定量检测的方法发现在急性饥饿应激条件下,细胞会显著抑制r蛋白的翻译,同时发现r蛋白降解主要通过非自噬蛋白酶体途径,而不是核糖体自噬途径。
为了揭示在饥饿应激条件下r蛋白水平的调控机制,团队首先开发了一种定量检测方法,用于分析r蛋白的丰度、合成、更新和分配,并且适用于细胞群或者单细胞检测。
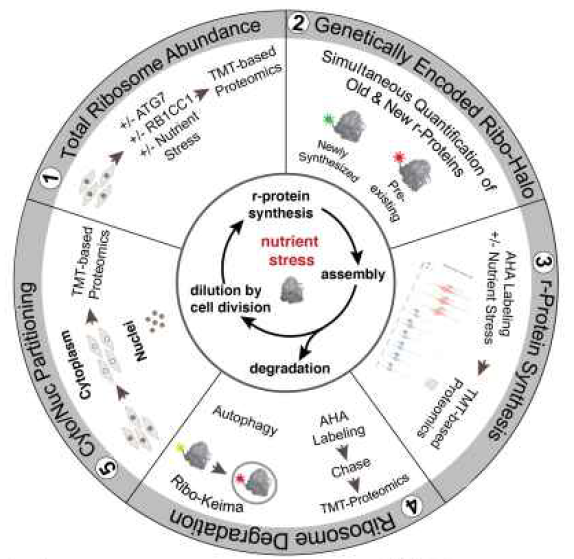
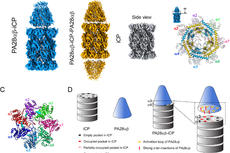
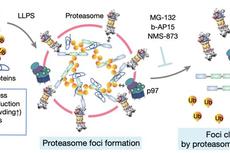
核糖体蛋白丰度定量分析框架示意图
首先第一步作者利用11-plex tandem mass tagging
(TMT)-based proteomic定量蛋白组学分析整个细胞蛋白水平在不同条件下的变化情况。作者使用了缺失了自噬重要参与基因
(ATG5/7或者RB1CC1)的HEK293 HCT116 293T细胞,给与氨基酸饥饿或者mTOR小分子抑制剂Torin1 处理,之后蛋白质组学定量分析发现自噬cargo蛋白和内质网蛋白水平在上述条件下明显下降,但是下降依赖于自噬过程。相比80种r蛋白,其中有70种r蛋白水平仅适度下降
(4.6-11.6%),并且与自噬无关。
然而这与先前的研究相矛盾,类似的情况下有研究利用Ribo-Keima报告系统观察到了核糖体自噬的发生。因为r蛋白的丰度受翻译。降解以及细胞减数分裂的影响。为了同时能够检测新合成的r蛋白,作者将Halo cassette与HCT116、293T或者HEK293中内源RPS3和RPL29基因的C末端融合,作者称Ribo-Halo。这种标记不影响r蛋白的翻译、丰度变化以及对mTOR信号的反应。作者用流式检测Tor1处理细胞14小时后发现,细胞的平均荧光强度下降了25%,同时作者发现细胞直径减少了约10%,即体积减少了25%,这样能够保持单个细胞中RPS3和RPL29的密度。总蛋白组学检测无法检测到这些变化。接下来作者先用红色halo标记细胞一个小时后,洗去游离配体,之后再用绿色halo标记新翻译的r蛋白。检测发现随着细胞分裂,新翻译的r蛋白逐渐增加比重,16小时后能够观察到50%预先存在的r蛋白。用Tor1抑制后,预先存在的r蛋白稀释减少,新合成的r蛋白也减少,总的减少10-30%,细胞分裂也减少。但是mTOR抑制剂处理后,在缺乏ATG7或RB1CC1的细胞里没有观察到新r蛋白丰度、合成和细胞大小的变化。因此mTOR抑制时,新r蛋白生成减少,先前存在的r蛋白稀释速度变慢。
接下来作者利用azidohomoalanine
(AHA)标记新和成的蛋白质,之后使用TMR炔凝胶内定量或者基于链霉素亲和树脂的TMT的纯化蛋白组学
(AHA-TMT)技术系统分析饥饿应激时r蛋白的合成情况。在mTOR抑制和氨基酸饥饿下,TMR检测显示总翻译量降低了60-70%,AHA-TMT蛋白组学量化了8200多种蛋白翻译发现,大多数的蛋白翻译受到抑制,r-蛋白的翻译抑制超过一半。其中mTOR对r-蛋白的选择性抑制作用大于氨基酸饥饿。ATG7和RB1CC1缺失的细胞的翻译抑制程度与野生型细胞相当。因此r-蛋白的翻译抑制有助于在急性饥饿应激状态下调控核糖体丰度。细胞在急性应激条件下通过自噬回收氨基酸的能力没有受到影响。
为了探究整个细胞蛋白组的降解变化,作者用AHA标记细胞1h后分析蛋白质的降解情况。在定量分析的蛋白质组中,作者发现了三种模式:自噬依赖性降解;mTOR抑制后不依赖自噬的蛋白酶体降解;mTOR抑制后自噬不依赖性稳定蛋白。而r-蛋白属于第二种类型。mTOR抑制后,r-蛋白快速周转不依赖于自噬途径。
通过以上分析作者认为处于自噬能力缺乏的饥饿应激状态下,细胞的反应并没有明显的缺陷。因此作者通过Ribo-Keima量化了核糖体自噬。Tor1处理10h后,溶酶体中约3-4%的核糖体被降解,这与以上研究结果一致。作者利用核糖体自噬
【2】缺乏的细胞即NUFIP1缺失的293T细胞研究发现在饥饿应激下r蛋白的蛋白丰度依然下降。因此在饥饿应激条件下,核糖体自噬并不需要NUFIP1
(Sabatini2018年发表的Science工作,详见:Science长文丨David Sabatini组关于核糖体自噬的关键发现)。
r-蛋白富含碱性氨基酸以及rRNA,作者想检测是否特定氨基酸和嘌呤饥饿会导致核糖体自噬。于是作者首先选择性的对细胞进行了Arg,Lys或Leu饥饿,但是核糖体自噬变化量均小于3.4%,表明碱性氨基酸的饥饿应激并不能选择性的促进核糖体自噬。利用6-羟基嘌呤抑制肌酐磷酸和鸟苷磷酸的产生,也并不能诱导核糖体自噬。这些都表明特定的营养饥饿应激也不能诱导核糖体自噬调控r-蛋白丰度。
该研究利用一系列定量研究,探究了在急性饥饿应激条件下,翻译抑制和非自噬蛋白酶体降解机制对r蛋白丰度的调控作用,以及在蛋白质组重塑中的影响。本研究也发现约10%的内质网蛋白会在氨基酸饥饿10h内通过自噬依赖性降解。鉴于内质网蛋白在饥饿应激状态下对蛋白质组重塑的重要性与r-蛋白相当,这表明在此种状态下,例如肿瘤发生背景下
【3】,内质网蛋白应该是自噬降解的主要目标分子。
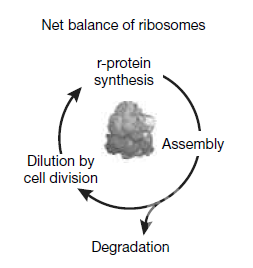
核糖体丰度调控环节
本研究中,作者全面分析饥饿应激条件下r-蛋白丰度调控机制。细胞饥饿应激下,r-蛋白翻译抑制、稀释核糖体库存降低细胞增殖,以及r-蛋白的非自噬蛋白酶体降解参与了r-蛋白丰度关键调控和细胞全蛋白组重塑。但是相关泛素连接酶仍然未知,尚需深入研究。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652490335&idx=1&sn=fa9b30be8bdb15cb5aab2b54d3cdb294&chksm=84e259ebb395d0fd80b36d0addd46ea5bebd7ce989d7daf496708c437f9e8a50a390779d12f9#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

 核糖体蛋白丰度定量分析框架示意图
核糖体蛋白丰度定量分析框架示意图