科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-23
来源:BioArt
细胞自噬是真核生物在饥饿或其他不利条件下,将细胞内自身不重要的蛋白质或细胞器等用杯型双层膜结构的自噬前体包裹,封口成为闭合自噬体后与液泡/溶酶体融合,被水解酶降解后释放到胞质中循环利用的一种途径,与各种生理及病理过程密切相关。日本科学家大隅良典因在细胞自噬机制研究方面的开创性突出贡献而获得2016年的诺贝尔生理或医学奖。细胞自噬因其重要性而受到国内外学者的高度关注,但从机制到应用研究仍有许多未解之谜,如自噬前体究竟是受到什么蛋白调控进行封口成为闭合自噬体的?
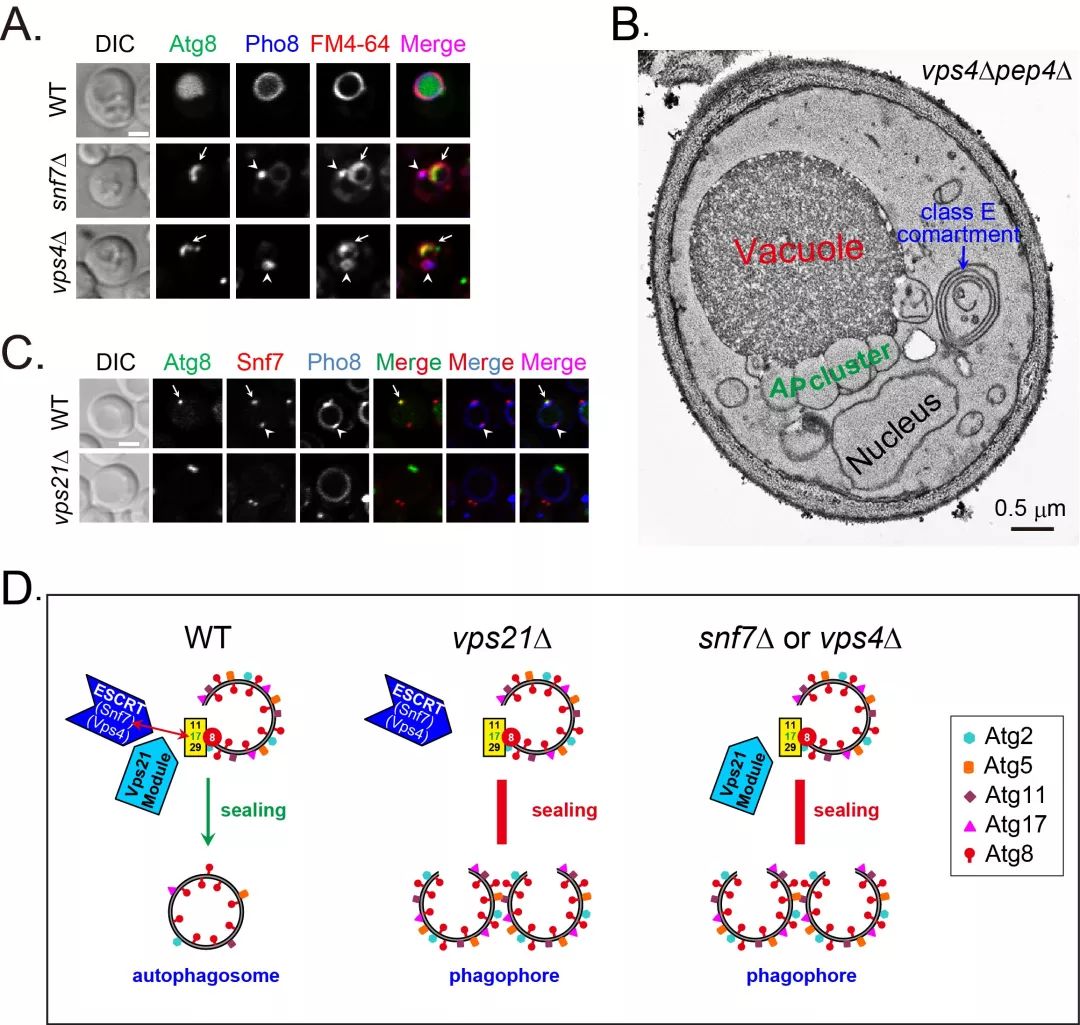
南京农业大学生科院梁永恒教授课题组近年一直在关注并研究自噬前体如何封口成为自噬体。该课题组2014年在Molecular Biology of the Cell上报道了参与囊泡运输的Vps21/Rab5模块蛋白缺失后造成自噬体状膜结构在液泡外贴近液泡膜的位置大量堆积,不能与液泡融合去完成自噬过程【1】。该课题组继续分析了这些堆积在液泡膜外的自噬体状膜结构的特性,发现它们是没有闭合的自噬前体,并于2017年在PLoS Genetics上首次明确报道Vps21/Rab5模块蛋白参与调控自噬前体闭合【2】,但至此仍没有解析Vps21/Rab5模块蛋白调控自噬前体闭合的分子机制。
4月22日,Journal of Cell Biology在线发表了梁永恒教授课题组和伊利诺伊大学芝加哥分校Segev研究组的联合研究成果 Rab5-dependent autophagosome closure by ESCRT。研究揭示了Vps21/Rab5通过调控ESCRT复合体,一种对细胞内多种膜性细胞器具有封口或修复能力的“多面手”,对自噬前体封口的作用机制。

本文研究中,作者通过荧光显微镜和电镜观察,生化实验检测发现ESCRT复合体主要亚基Snf7和Vps4缺失后也产生与vps21∆类似的自噬缺陷表型,即产生未闭合的自噬前体。体内外实验证实Snf7和Vps4确实可以对来自相应突变体的自噬前体进行封口。但Vps21/Rab5蛋白与ESCRT复合体在细胞自噬过程中究竟有什么样的关系?
更进一步的实验发现Snf7在vps21∆菌株中无法被招募到自噬前体上,也无法与自噬前体上的Atg17互作,因而ESCRT复合体无法在自噬前体上行使封口功能。当该课题组采用一种NanoTrap的技术,人为使vps21∆菌株中不能发生互作与共定位的Snf7与Atg17进行共定位后,惊喜地发现vps21∆菌株中的细胞自噬缺陷表型得到了恢复。这些结果说明Vps21至少通过控制Snf7与Atg17的互作将ESCRT复合体招募到自噬前体上行使封口功能。
据悉,南京农业大学已毕业博士生周帆、在校博士生吴祖林为共同第一作者,梁永恒教授和伊利诺伊州立大学芝加哥分校的Nava Segev教授为共同通讯作者。实验室的多名其他研究生及浙江大学的周以侹教授,上海交通大学的谢志平教授和北京大学的陈良怡教授课题组等也参与了该研究。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469086&idx=4&sn=1a473539ffc5bff66a2c0446784133ba&chksm=84e2e4eab3956dfcf56c78d877a37a55e905e70bda0c54cf9d64453d0a90fbcb5ebb2ded23e2&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

昆明动物所等在百岁老人健康长寿保护机制研究中取得进展----中国科学院

《自噬》发表宋质银课题组线粒体自噬新成果
【学术前沿】Cell/Cell Res | 清华大学葛亮团队发现自噬体生物发生的重要调节新机制

基因组研究揭示寿星健康保护机制
上海有机所等发现延缓受损神经退化新机制

Sci.Adv:自噬激活协同自噬通量阻断抑制肿瘤生长和转移

细胞自噬关键蛋白突变可延寿

少吃是关键!中国科学家发现长寿机制

复旦大学鉴定出4种自噬体连接化合物有望治疗亨廷顿舞蹈病等polyQ疾病
自噬SNARE蛋白Syntaxin17介导自噬体-溶酶体融合的分子机制