科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-21
来源:X一MOL资讯
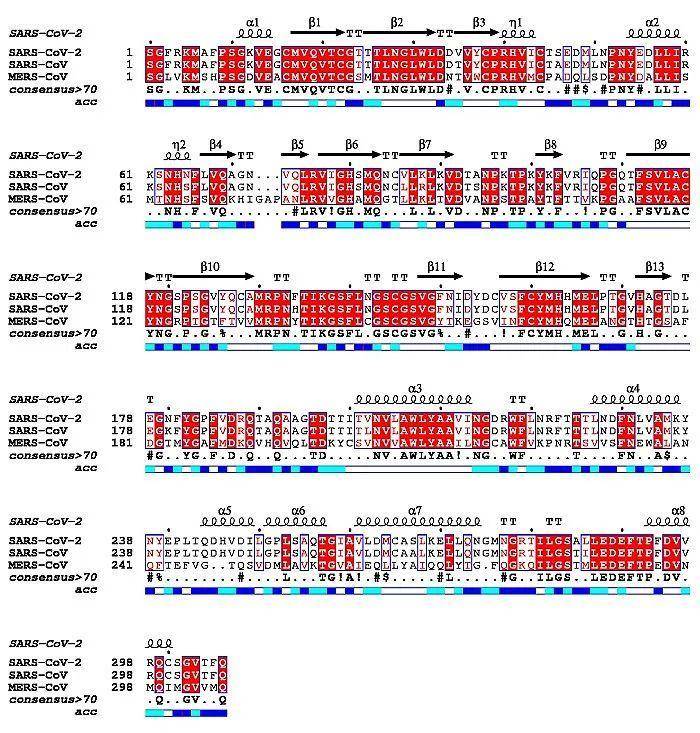
自2019年12月以来,新型冠状病毒席卷全球,绵延至今已造成多达400万人感染和超过30万患者的死亡。更为遗憾的是,针对该疾病尚无临床特效的药物用以治疗。冠状病毒的主蛋白酶(3C样蛋白酶)对于冠状病毒的生命活动极为重要,是抗冠状病毒药物设计的重要靶点。现阶段针对该类蛋白酶的研究主要集中于其底物的特异性研究和二聚化的研究,然而对其催化机制缺乏系统性地研究,制约了其相应抑制剂的发展。因此,亟待洞悉冠状病毒主蛋白酶的催化机制,更好地设计和发现抑制剂。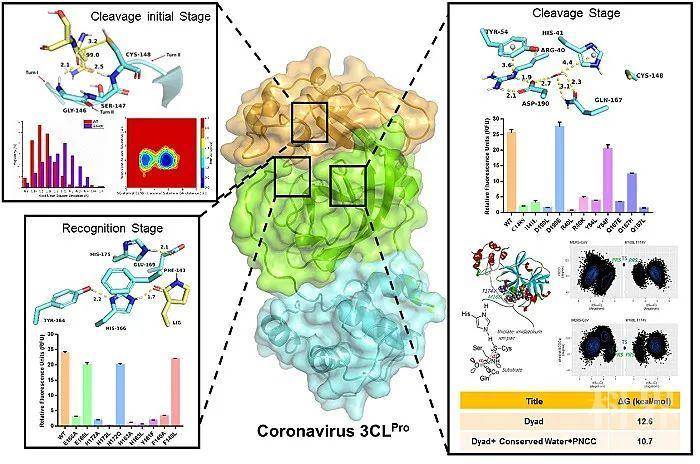
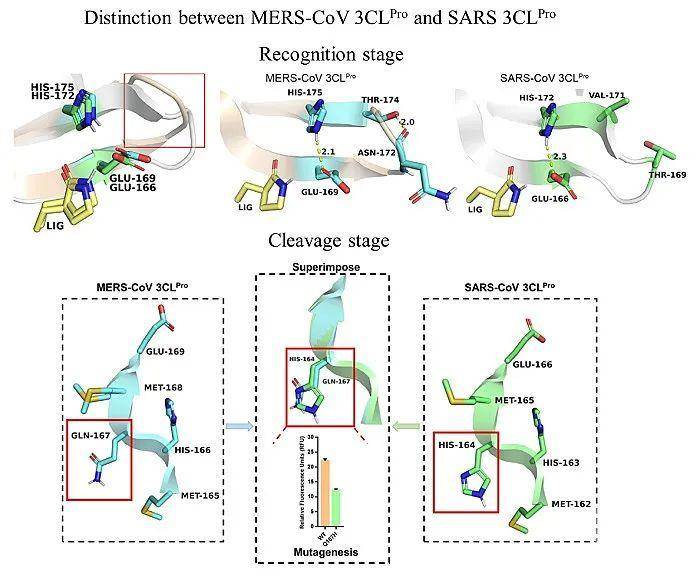 图2. MERS-CoV和SARS-CoV 主蛋白酶催化过程中的区别研究。
图2. MERS-CoV和SARS-CoV 主蛋白酶催化过程中的区别研究。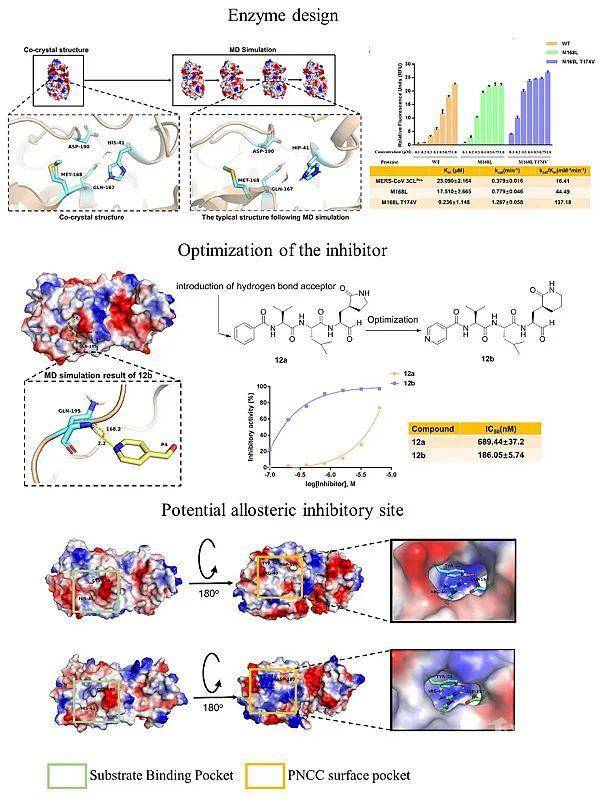
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657637021&idx=6&sn=76690725b5b80f689bbe759449a83777&chksm=80f87b4db78ff25b6f7061b6ea9b3ad46f3833d7805ea5c07824aafa27571eb54c6e4aac641b&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

病毒,不单单是“祸害”

Nature正式发表!上科大等团队成功解析新冠病毒主蛋白酶三维结构
木瓜凝乳蛋白酶

中科院等科学家合作研究解析新冠病毒主蛋白酶三维结构,并发现多个抑制剂

研究发现Calpain蛋白酶活化新机制

张进/李健团队揭示中药活性成分紫草素抑制新冠病毒主蛋白酶的分子机制

Nature正式发表!中国研究人员成功解析新冠病毒主蛋白酶三维结构
《自然》发文:麻省理工学院发现海洋中一种未知病毒

你身体里也有病毒基因:存在于众多生命中

最新研究:流感病毒有望得到遏制