科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-21
来源:中国高科技
CRISPR/Cas9的衍生工具DNA单碱基编辑技术可以在不切断DNA双链的情况下实现单核苷酸的定向突变,为单碱基突变引起的遗传性疾病的治疗带来了希望,自2016年首次报道以来受到了广泛的关注。2019年,单碱基编辑工具的安全性受到了质疑,先是杨辉等研究组报道了胞嘧啶单碱基编辑器存在严重的DNA脱靶,接着Keith Joung团队、David Liu团队和杨辉团队又分别报道了胞嘧啶单碱基编辑器和腺嘌呤单碱基编辑器存在大量的RNA脱靶效应。虽然先前的研究中通过引入突变的方式显著降低了RNA的脱靶,但是胞嘧啶单碱基编辑器的DNA脱靶依然没有得到解决。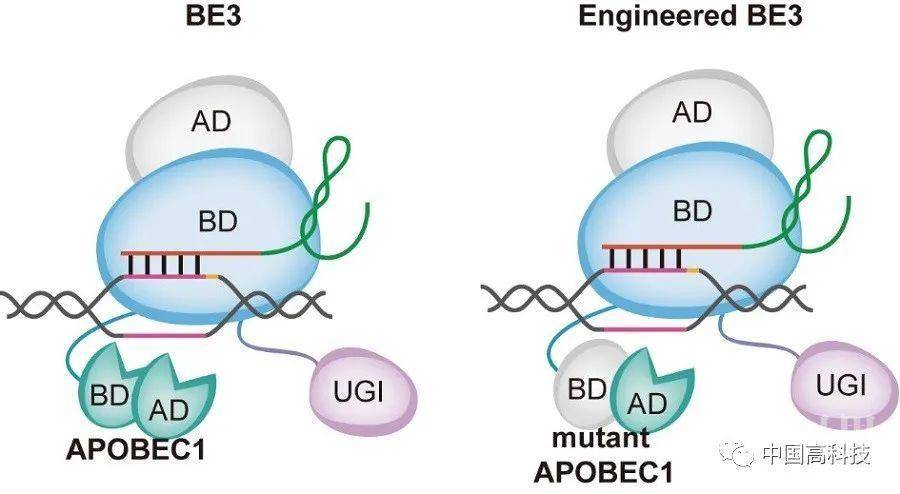
来源:cas-hitech 中国高科技
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MDczMTAzMA==&mid=2650049353&idx=1&sn=954c8c7f2c59679ed212dffffba7789d&chksm=87387f30b04ff6268da0c5b97ee04d8d600ace0c3696da508ced74c262b0527ea98e58a307d8&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中国科技新闻学会倡议书

【前沿】一周科技新闻

DNA机器人一小步 癌症治疗一大步

2020年国内十大科技新闻
非对称聚合物材料可制造灵活多变的软机器人
王艳丽:做研究就像破案

新研究揭开人类头发曲直的秘密

2019年“湖南十大科技新闻”揭晓

【纵览】一周科技新闻

中国科技新闻学会祝您元旦快乐!