科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-26
来源:brainnews
离子通道领域专家介绍
通过表型筛选发现先导化合物,结合“me too”类药物开发,在上世纪50年代至80年代间产生了一批靶向离子通道的药物。之后利用表型筛选获得离子通道药物的难度越来越大,鲜有重要突破。人们寄希望于离子通道生物学突破帮助实现新药的理性发现,但是上世纪90年代至今离子通道结构和功能研究的突飞猛进未能有效推动靶向离子通道的药物发现,主要原因是离子通道调控剂发现面临的难题并未被解决,离子通道生物学和药学依然处于相互割裂的状态。在三个最重要的药物靶标来源蛋白质家族中,GPCR和激酶的高通量筛选技术成熟,易获取活性小分子,而离子通调控剂发现长期面临如下难题[1]:1)缺乏有效的离子通道药物高通量筛选技术;2)大部分离子通道是非配体门控的,缺乏明确的小分子结合口袋,这使得基于结构的分子设计难以实施;3)大量离子通道序列和结构高度相似,使得小分子调控剂缺乏选择性。
随着我国化学生物学学科的发展,成长出的一批本土青年人才正在发展新方法和新技术,努力解决上述难题,力图在离子通道生物学和药学之间搭建一座桥梁。本期“离子通道本土专家”将介绍该领域的专家之一:阳怀宇。
本期专家:阳怀宇
化学与生物碰撞出离子通道电火花
我是阳怀宇,华东师范大学生命科学学院教授,目前主要从事离子通道的化学生物学研究,致力于为神经系统离子通道寻找动态调控小分子,进而以此为探针发现和确证治疗重大神经疾病的新靶标。

阳怀宇教授
我在南京大学化学化工学院获得学士学位,之后在中科院上海药物所跟随蒋华良研究员攻读博士学位。早期开展离子通道动态门控机制研究时,与徐天乐教授课题组的于烨和李伟广等同学合作,开始进行化学与生物的交叉研究[2]。
工作后继续深入开展跨膜蛋白动态构象的理论计算和功能实验,研究发现一些离子通道的静态晶体结构缺乏调控空腔,但是在它们发生动态构象变化的时候可能产生合适的空腔,因此有可能设计小分子去特异地“锁定”离子通道的某个动态构象。这些小分子可能直接调控或间接变构调控孔道构象。为此我着重建立基于离子通道动态构象的小分子调控技术体系,用于发现离子通道小分子调控剂和研究小分子的调控机制。与上海药物所高召兵研究员的合作课题发现了抗癫痫KCNQ2通道的调控位点、调控机制和激动剂[3] [4]。
初期的技术体系运用是针对已报道了小分子调控剂的离子通道,并不是“从0到1”的原创小分子发现,也没有解决“选择性”难题。近年我课题组进一步完善基于离子通道动态构象的小分子调控技术体系,能高效发现选择性小分子调控剂和揭示动态调控机制。将这一技术体系用于研究神经细胞膜电位相关的双孔钾离子(K2P)通道,与四川大学华西医院蒋若天研究员合作发现调控TASK-3(K2P9.1)通道动态构象的选择性激动剂,以此为探针发现和确证TASK-3是可以治疗多种疼痛的新靶标[5];与上海药物所李扬研究员发现调控TREK-1(K2P2.1)通道动态构象的选择性抑制剂,并进而揭示TREK-1是快速抗抑郁新靶标[6]。
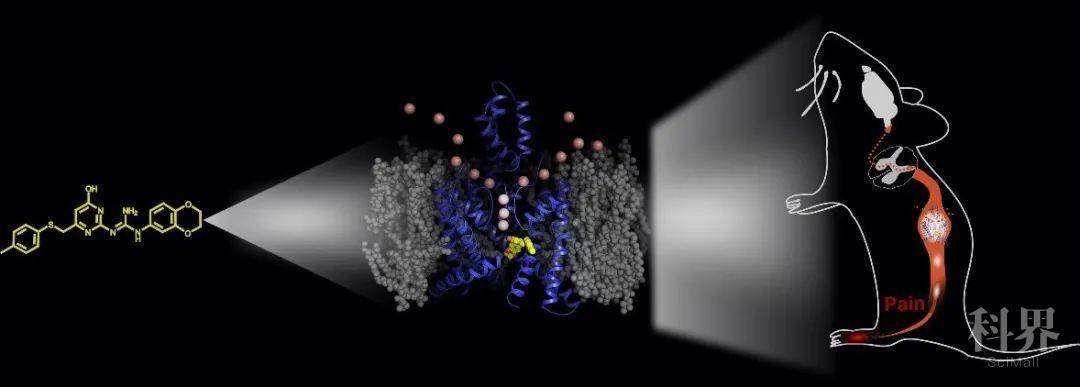
小分子驱动蛋白质靶标功能研究
课题组研究工作的奋斗目标是推动动态调控策略研究进入新领域,对离子通道调控位点和调控机制的认识从个案发展到完整理论体系,进而实现离子通道选择性调控剂发现效率的倍增或翻几番,并推动实现靶标发现和确证上台阶。
我深有感触的是交叉研究很艰难,离不开合作者的大力支持。我在研究过程中,得到了徐天乐、于烨、李伟广、高召兵、李扬和蒋若天等合作者的大力支持。还得到了沈兵教授等众多朋友的帮助。
我课题组研究生可以选择的研究方向主要有:动态构象研究、分子设计、人工智能、药物化学、电生理和药理学等。希望每位研究生能在两到三个方向上接受过培训,从而帮助获得处理未知复杂问题的自信心和能力。

课题组研究生
参考文献&推荐阅读
[1] Wulff H, Christophersen P, Colussi P, Chandy K G and Yarov-Yarovoy V (2019) Antibodies and venom peptides: new modalities for ion channels. Nature reviews. Drug discovery. 18:339-357.
[2] Yang H, Yu Y, Li WG, Yu F, Cao H, Xu TL and Jiang H (2009) Inherent dynamics of the acid-sensing ion channel 1 correlates with the gating mechanism. PLoS Biology. 7:e1000151.
[3] Zhang Q, Zhou P, Chen Z, Li M, Jiang H, Gao Z and Yang H (2013) Dynamic PIP2 interactions with voltage sensor elements contribute to KCNQ2 channel gating. Proceedings of the National Academy of Sciences of the United States of America. 110:20093-20098.
[4] Li P, Chen Z, Xu H, Sun H, Li H, Liu H, Yang H, Gao Z, Jiang H and Li M (2013) The gating charge pathway of an epilepsy-associated potassium channel accommodates chemical ligands. Cell Research. 23:1106-1118.
[5] Liao P, Qiu Y, Mo Y, Fu J, Song Z, Huang L, Bai S, Wang Y, Zhu JJ, Tian F, Chen Z, Pan N, Sun EY, Yang L, Lan X, Chen Y, Huang D, Sun P, Zhao L, Yang D, Lu W, Yang T, Xiao J, Li WG, Gao Z, Shen B, Zhang Q, Liu J, Jiang H, Jiang R and Yang H (2019) Selective activation of TWIK-related acid-sensitive K 3 subunit-containing channels is analgesic in rodent models. Science Translational Medicine. 11: eaaw8434..
[6] Luo Q, Chen L, Cheng X, Ma Y, Li X, Zhang B, Li L, Zhang S, Guo F, Li Y and Yang H (2017) An allosteric ligand-binding site in the extracellular cap of K2P channels. Nature Communications. 8:378.
注:图片由原作者提供,版权归原作者所有
本文作者丨阳怀宇团队
编辑丨汪瑞琦
来源:brainnews brainnews
原文链接:https://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649572966&idx=5&sn=9ef46de741f823fc5468a6226b875e29&chksm=f2eda092c59a2984709eefe5343ddcd7f8fdad529e67298bf9d71cd50408a1360554f1df53b7#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
【药化】利用同源保守区域也可设计得到离子通道选择性小分子

顺利闭幕|第八届国际离子通道大会

【大师讲堂】叶公杼:离子通道是如何工作的?

心跳触发器——钠离子通道的原子视图

西安交大科研人员在Lewis碱催化领域取得新进展

钠离子通道与疼痛研究获进展

会议通知|第八届国际离子通道大会
从氯胺酮抗抑郁新机制探讨靶向离子通道的新药研发
关于突触前钙离子通道的探索和研究
宁波材料所葛子义团队《德国应化》:在全小分子有机太阳能电池研究取得重要进展