科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-28
来源:逻辑神经科学
化学性突触是一类在神经元之间的突触连结,通过突触前囊泡释放神经递质,将电信号转化为化学信号,将冲动传递到下一神经元。电压门控钙离子通道(Voltage-gated Ca2+ channels, 简称Cav)在突触前膜的囊泡融合及神经递质的释放过程中扮演了重要角色。这些离子通道的活性以及在突触前膜活性区域的分布数量调控着突触传递的时序以及强度。先进的检测手段让我们能够清晰的观察到电压门控钙离子通道如何调节突触前膜的活动。
近期,英国伦敦大学学院神经科学、生理和药理学系的Annette C. Dolphin教授 、与美国爱荷华大学分子生理学与生物物理学系Amy Lee的教授共同在Nature Reviews Neuroscience 上撰写了题目为Presynaptic calcium channels: specialized control of synaptic neurotransmitter release 的综述文章。作者详细阐述这些离子通道的分类,它们如何被运输、锚定于突触前膜以及如何在神经环路中精准的调控信息的传递。 在此,“逻辑神经科学”以中文的形成,分为上下两个部分,对此篇综述文章的核心内容进行逻辑性提取,仅供读者朋友学习及启发。
Cav 在突触部位的组织机制
Cav在突触前与近200种蛋白相互作用,保证了能够在动作电位到达的第一时间释放囊泡,将冲动传递至下一神经元。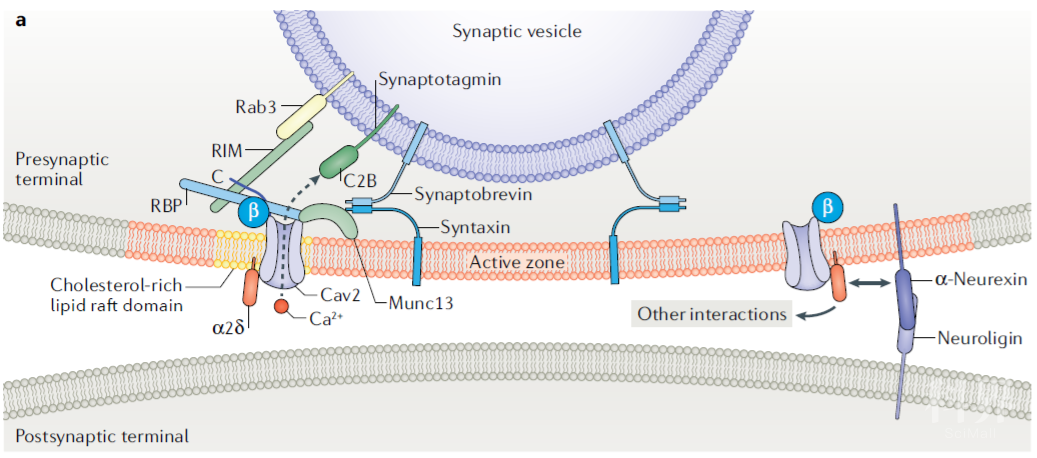
Fig.6 图中列举了位于突触前活跃区参与Cav2复合体锚定和发生相互作用的蛋白。包括:位于突触囊泡膜表面的Rab3、synaptotagmin 和 synaptobrevin;位于胞浆内的RBPs以及位于突触前膜内侧面的Munc13和syntaxin。
(图片引自:Dolphin, A.C., Lee, A. Nat Rev Neurosci. 2020; 21)Rab3- interacting molecules(RIMs) RIM 蛋白家族是Cav2.1与Cav2.2最重要的组织蛋白。他们通过PDZ 结构域与α1亚基C末端的保守结构域DxWC结合,直接调节Cav复合体的募集,或通过与 RIM-binding proteins (RBPs)结合,间接的调控Cav的募集。在小鼠脑中敲除RIMs/RBPs 能够显著降低Cav2.1与Cav2.2在突触前的密度。
α2δ α2δ与α1亚基间的相互作用在Cav复合体的聚集过程也发挥了着重要作用。敲除α2δ-1与α2δ-4能够减少脊髓后角传入纤维末梢Cav2.2与视网膜感光细胞Cav1.4的聚集。α2δ与轴突蛋白(neurexins)相互作用,后者通过与突触后膜的神经连接蛋白(neuroligin)结合,维持突触前膜与后膜间信号的匹配(alignment)。
位于突触前活跃区的Cav复合体是如何在与众多的蛋白发生相互作用的同时依然能够保持一定的膜上活动性(mobility),调节突触前囊泡释放,仍需进一步探索。Munc13 Munc13与RIM、ELKS以及位于突触前膜的突触融合蛋白(syntaxin)在近膜区(juxtamembrane)形成环状复合物一同锚定SNARE (NSF附着型的蛋白受体),使之能够在发生Ca2+内流时,顺利引导突触囊泡与突触前膜融合。
Synprint site Cav2.1 与Cav2.2 α1亚基的II和III结构域含有突触蛋白相互作用位点,能够与SNARE、突触融合蛋白等结合,调控突触囊泡释放。
突触前Cav 的调控一些G蛋白偶联受体能够通过特定的通路与Cav复合体结合,抑制突触前膜神经递质的释放。在脊髓后角中,G蛋白βγ亚基能够电压依赖性的通过与Cav2 β亚基结合,降低Cav2电流,抑制突触前递质释放。
Cav受蛋白激酶调控PKC 由Cav介导的神经递质释放能够被包括蛋白激酶C(protein kinase C,PKC)在内的一系列蛋白激酶调节。PKC能够被PMA(phorbol 12- myristate 13- acetate)激活,然后通过磷酸化Gβγ的结合位点,从而对抗GPCR对于Cav2.2的抑制作用。
CDK5 CDK5(cyclin- dependent- like kinase 5)在实验中被证实对Cav2 的调控有着多重的作用。在位于突触前末梢内的CDK5能够磷酸化Cav2.1 α1亚基内的特定位点,使Cav电流减弱,并且阻止Cav与SNAP25和synaptotagmin的相互作用,从而降低突触前囊泡的释放量;而位于神经元胞体的CDK5能够增强胞体Cav2.2的电流并且增强突触神经递质的释放。由此可见,CDK5对于Cav的调节作用与其所在的神经元的区域以及神经元内磷酸化活性有着密切关系。
β亚基 β亚基还能够通过与多种蛋白激酶(如PKA)发生不同位点的磷酸化以及其他翻译后修饰调节Cav复合体的功能,这种调节方式及其效应有待进一步的研究。
Cav受突触前活跃区脂类物质调控胆固醇 胆固醇是突触前膜的重要组成成分。突触前膜上许多富含糖基磷脂酰肌醇的蛋白质,如α2δ亚基等就锚定在前膜富含胆固醇的区域。因此猜测胆固醇对于突触前活跃区通道蛋白的富集有一定作用。
PIP2 (phosphatidylinositol 4,5-bisphosphate PIP2) PIP2是细胞膜胞内面的成分之一,是胞内锚定RIMs、synaptotagmin等突触蛋白的重要结构。在胞内短时间内高表达PIP2能够增强胞吐作用。并且GPCR能够通过激活磷脂酶C,耗尽PIP2,从而减弱Cav的Ca2+内流,减少突触递质释放。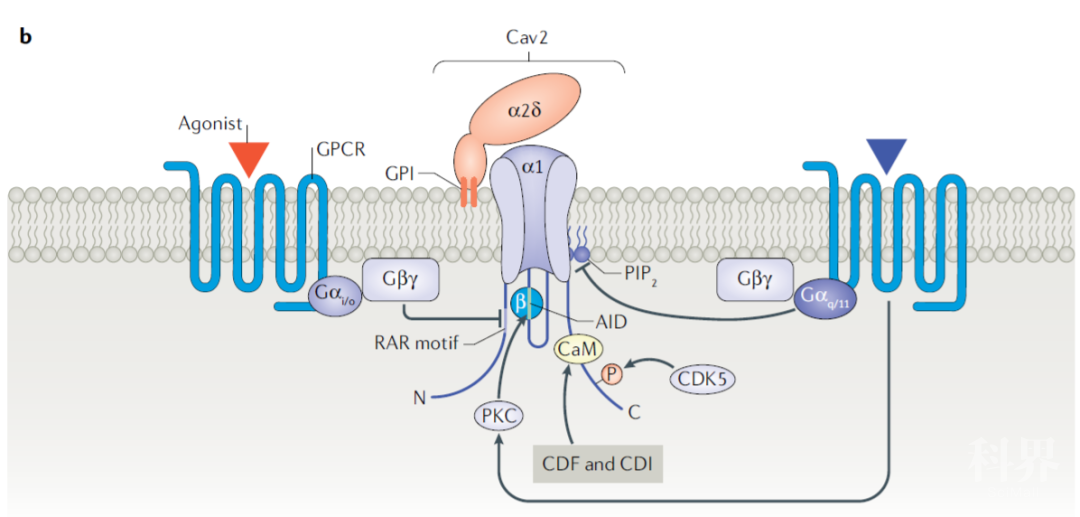
Fig.7 调节Cav2复合体的主要通路。包括GPCRs(抑制Cav2活性)和PKC,CDK5(增强Cav2活性)
(图片引自:Dolphin, A.C., Lee, A. Nat Rev Neurosci. 2020; 21)
突触前Cav相关通道疾病
与神经调节相关FHM1 1型家族性偏瘫性偏头痛(familial hemiplegic migraine type 1,FHM1),是由于CACNA1A 基因发生错译,导致R192Q 或 S218L的突变导致的。这一突变导致脑内皮质锥体细胞(多巴胺能)突触中,动作电位介导的Cav2.1 Ca2+内流大幅增强,
与精神类疾病相关编码Cav各个亚基的基因以及突触前蛋白基因与多种精神类疾病相关。CACNA1C, CACNB2, and CACNA1I 以及 RIM,neuroligins 等与精神分裂症相关;RIM3 与 自闭症相关。Cav2 与 脆弱X综合征(Fragile X syndrome)有密切联系。
总结
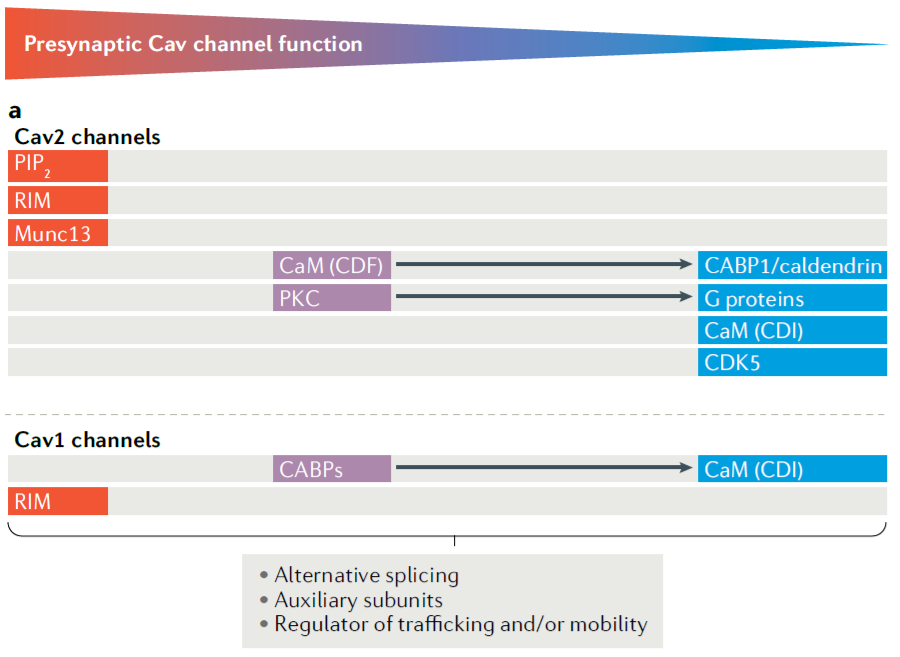
Fig.8 列举了突触前Cav的主要类型以及参与调控Cav功能的主要蛋白。红色表示对Cav活性有促进作用,蓝色代表抑制作用。箭头相连的两类蛋白表示具有相反作用的两类蛋白。
(图片引自:Dolphin, A.C., Lee, A. Nat Rev Neurosci. 2020; 21)
利用电子显微镜、高分辨率成像系统,电生理,时间分辨成像等技术,已经让我们能够确定不同突触末梢的Cav类型以及确定与Cav功能相关的调节蛋白类型。但现存的疑问依然很多:1. Cav复合体是通过何种途径准确的运输至突触前末梢;
2. 不同细胞类型中,Cav种类相对保守,而维持Cav的这种细胞特异性的原因依然不清;
3. 在体/在特定神经环路中验证体外对于Cav调节神经递质释放的相关机制;
4. Cav复合体在不同轴突内的特异性分布对于神经环路的调节功能。
综上,本综述对突触前电压门控钙离子通道的结构、转运、功能以及其对突触前膜囊泡释放的调控进行了详细的介绍。同时也提出了一些假设以及目前尚未解决的难题。
来源:LT-Neuroscience 逻辑神经科学
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4Mjk3NzUxOQ==&mid=2247487226&idx=1&sn=6e82d348dabc8f264b9438c71260dfaf&chksm=eb90fb7adce7726cc2d8b6f0ebf332474db0bd794131774faecef3ceb830ee65794389aa8d27#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
神经科学: “快进”脑补看生活

张旭:“画”出神经科学之美
神经科学:如何在睡眠中学习
神经科学:睡前消消气

神经科学揭秘鲨鱼放电原理
你如何控制你自己?科学家揭示自由意志的生物学本质

科学家揭示自由意志的生物学本质
神经科学:神经反应或可预示友谊

自由意志感的神经科学解释

中国神经科学的科学脊梁