科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-28
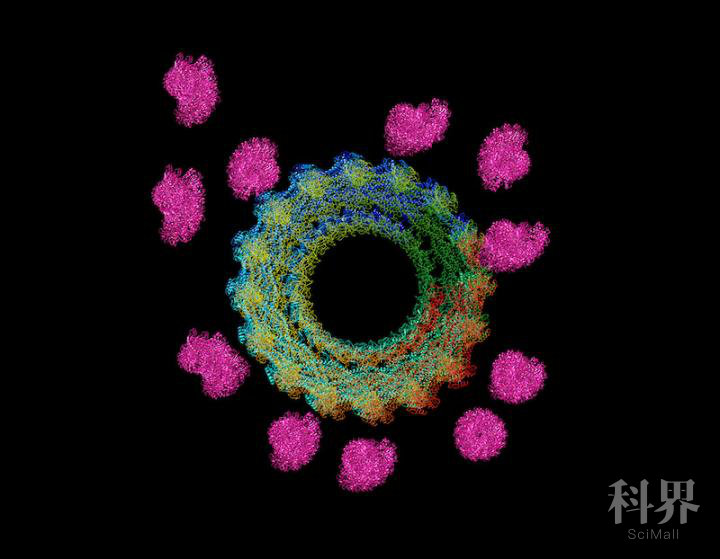
许多细胞在完成自身的基本功能时,会形成伪足,侵入其它细胞的领地,并与之融合。例如,肌肉细胞会相互融合,形成肌肉纤维发挥作用。然而在这个过程中,细胞伪足是如何形成的还不为人知。
近日,来自美国德克萨斯大学西南分校的科学家们在《自然·细胞生物学》网站上发表论文,概述了细胞融合过程中伪足形成的机制,并重点阐释了肌动蛋白(actin)和发动蛋白(dynamin)之间的相互作用。这一发现帮助我们进一步理解了细胞融合的过程,并可能有助于开发针对罕见肌肉疾病的新疗法。
“细胞融合包括三个主要步骤。”该研究的领导者Elizabeth Chen博士解释道,“首先,粘附分子将细胞膜聚集到一起,但细胞之间仍有空隙;接下来,一个细胞伸出手指状的伪足,侵入另一个细胞;最后,融合蛋白使细胞膜更加接近并最终融合。”
Chen说,之前的研究已经表明,actin在形成伪足中起着关键作用。然而,actin形成的丝状聚合物,也就是actin微丝,非常细软,直径只有7 nm。那这些纤细的微丝是如何变得足够坚硬,从而推动入侵其他细胞的伪足形成呢?
为了解决这个问题,Chen等人研究了actin和dynamin的相互作用。在这项研究中,研究人员以果蝇的肌肉细胞为模型系统,观察了胚胎中肌肉细胞的融合。结果发现,如果没有dynamin,这些细胞不仅不能融合,也不能形成正常的伪足,这表明dynamin在这一过程中起着关键作用。
然后,研究人员使用显微镜进一步观察了纯化后的dynamin和actin在等比例混合时是如何互作的。他们发现,当多个dynamin分子聚集在一起时会形成螺旋结构,actin微丝会与dynamin螺旋的外缘结合,按一定的间隔排列成束,每个螺旋最多可捕获16条微丝。
虽然这个实验表明dynamin有能力捕获并保持多条actin微丝形成更强韧的纤维束,但是装配完全的dynamin螺旋不太可能在细胞中维持很长的时间,因为细胞中有充足的能量来源分解螺旋结构。果不其然,当研究人员在dynamin-actin混合物中加入能量源时,dynamin螺旋确实分解了,但并不是同步的。当装配完全的螺旋分解时,其他的部分仍然存在,保持着纤维束的形态,同时允许新的微丝从不受dynamin约束的区域释放出来。这样一个动态过程最终导致多个相互连接的平行actin纤维束的形成,进一步提高了actin网络的机械强度。
这些实验表明,动态的actin捆绑过程是细胞形成伪足以及与其他细胞融合的关键。
虽然这项研究使用了肌肉细胞作为模型,但Chen指出,dynamin和actin的互作也可能在其他类型的细胞融合中发挥关键作用,例如破骨细胞或免疫细胞之间的融合。
细胞融合过程中的缺陷可会能导致一些罕见的疾病,如中央核性肌病。先前的研究表明,dynamin的多种突变都可以导致这种疾病。
“我们想要知道突变是如何阻碍细胞融合过程的,这可能最终会帮助我们开发针对这种疾病的新方法。”Chen说。
科界原创 编译:花花 审稿:西莫 责编:张梦
期刊来源:《自然·细胞生物学》
期刊编号:1465-7392
原文链接:
https://www.eurekalert.org/multimedia/pub/232941.php
版权声明:本文由科界平台原创编译,中文内容仅供参考,一切内容以英文原版为准。转载请注明来源科技工作者之家—科界App。

【公示】中国细胞生物学学会/上海市创新细胞生物学发展基金会2021年资助项目公示

解密细胞生物学及转化医学中的泛素密码
中国细胞生物学学会/上海市创新细胞生物学发展基金会2022年资助项目公示
《细胞》发文!阿片类药物迎来重大突破
重磅推荐!Plant Cell公布了植物细胞生物学15个最重要的问题

Nature细胞生物学关键步骤新见解:染色体在细胞分裂后如何重组
细胞生物学: 模型原始细胞也许可预测原始细胞周期
停课不停学 《医学细胞生物学》变身线上精品课




中国细胞生物学学会-细胞治疗研究与应用分会第一届年会
2017年全国植物细胞生物学大会顺利召开


