科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-06
来源:BioArt植物
虫传病毒导致的植物病毒病害严重威胁着水稻等粮食作物的绿色健康生产。水稻条纹病毒(Rice stripe virus, RSV)是水稻条纹叶枯病的病原体。研究发现,RSV除了可以侵染水稻外,还可以侵染小麦、大麦以及玉米等禾本科作物。水稻条纹叶枯病的病症是心叶基部出现褪绿的黄白色斑条,进而发展成沿叶脉分布的黄白色条纹,严重时心叶整片黄化甚至枯死,一般无法抽穗或抽枯穗,导致水稻产量严重下降。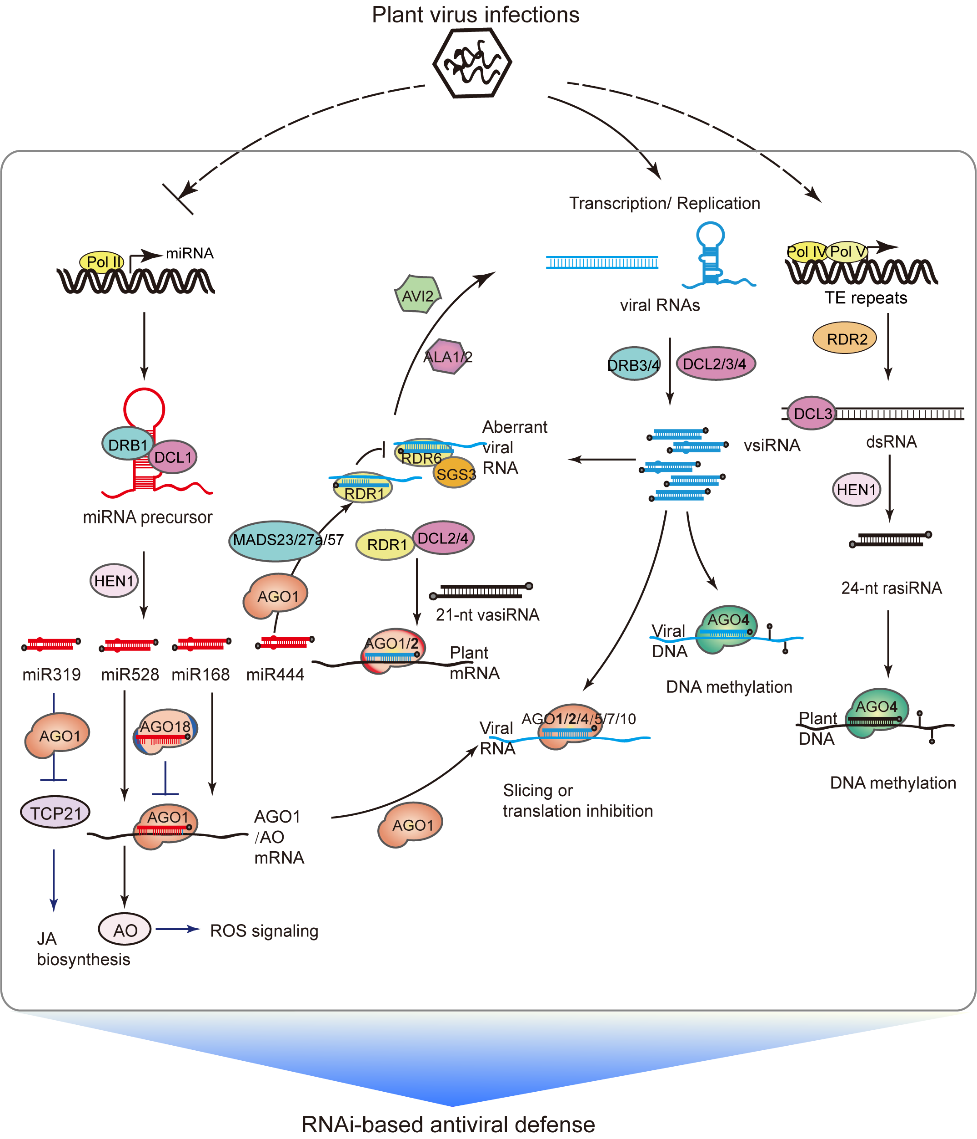 RNA沉默信号通路介导的植物抗病毒免疫
RNA沉默信号通路介导的植物抗病毒免疫
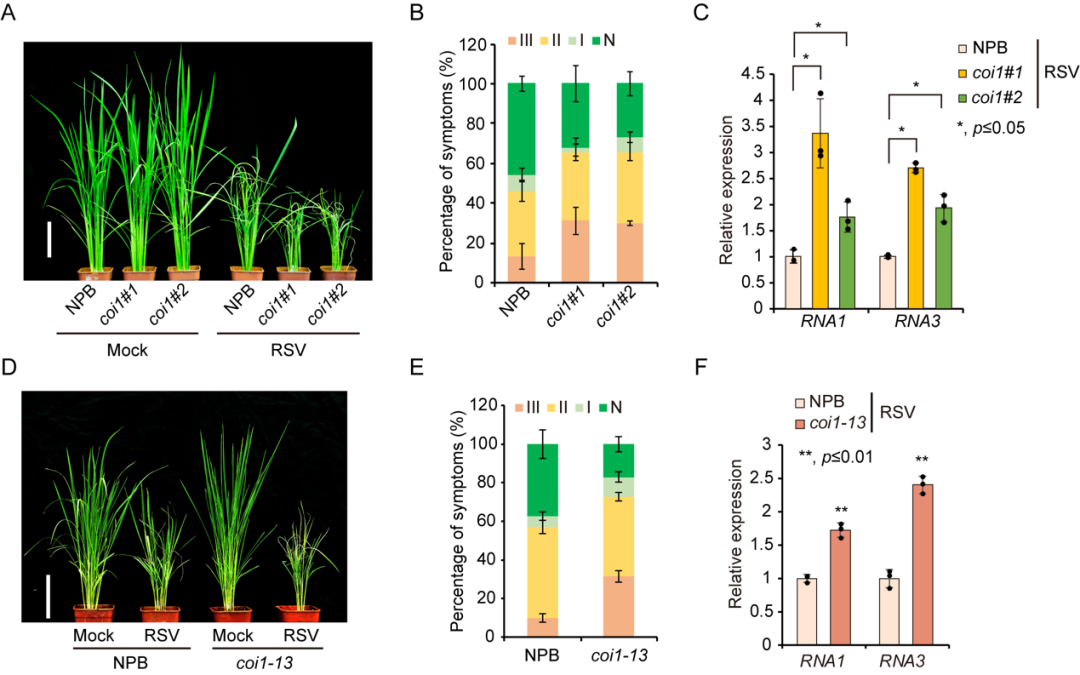 coi1相关突变体表现出对RSV侵染更加敏感的表型。
coi1相关突变体表现出对RSV侵染更加敏感的表型。 JA信号通路缺陷对RNA沉默组件表达的影响
JA信号通路缺陷对RNA沉默组件表达的影响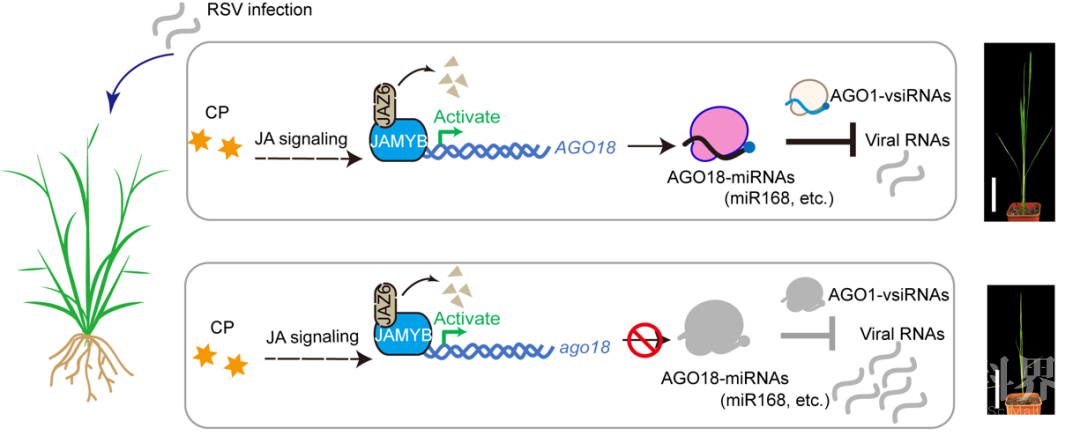
参考文献
【1】Baulcombe, D.C. (2004). RNA silencing in plants. Nature 431, 356–363.
【2】Guo, Z., Li, Y., and Ding, S.W. (2019). Small RNA-based antimicrobial immunity. Nat. Rev. Immunol. 19, 31–44.
【3】Du, P., Wu, J., Zhang, J., Zhao, S., Zheng, H., Gao, G., Wei, L., and Li, Y. (2011). Viral infection induces expression of novel phased microRNAs from conserved cellular microRNA precursors. PLoS Pathog. 7, e1002176.
【4】Wu, J., Yang, Z., Wang, Y., Zheng, L., Ye, R., Ji, Y., Zhao, S., Ji, S., Liu, R., Xu, L., et al. (2015). Viral-inducible Argonaute18 confers broad-spectrum virus resistance in rice by sequestering a host microRNA. Elife 2015, 1–19.
【5】Wu, J., Yang, R., Yang, Z., Yao, S., Zhao, S., Wang, Y., Li, P., Song, X., Jin, L., Zhou, T., et al. (2017). ROS accumulation and antiviral defence control by microRNA528 in rice. Nat. Plants 3, 16203.
【6】Yao, S., Yang, Z., Yang, R., Huang, Y., Guo, G., Kong, X., Lan, Y., Zhou, T., Wang, H., Wang, W., et al. (2019). Transcriptional regulation of miR528 by OsSPL9 orchestrates antiviral response in rice. Mol. Plant 12, 1114–1122.
【7】Yang, Z., and Li, Y. (2018). Disp of RNAi-based antiviral immunity in plants. Curr. Opin. Virol. 32, 88–99.
【8】Huang, Y., and Li, Y. (2018). Secondary siRNAs rescue virus-infected plants. Nat. Plants 4, 136–137.
【9】He, Y., Zhang, H., Sun, Z., Li, J., Hong, G., Zhu, Q., Zhou, X., Macfarlane, S., Yan, F., and Chen, J. (2016). Jasmonic acid-mediated defense suppresses brassinosteroid-mediated susceptibility to Rice black streaked dwarf virus infection in rice. New Phytol. 1, 1–12.
【10】Zhang, C., Ding, Z., Wu, K., Yang, L., Li, Y., Yang, Z., Shi, S., Liu, X., Zhao, S., Yang, Z., et al. (2016). Suppression of jasmonic acid-mediated defense by viral-inducible microRNA319 facilitates virus infection in rice. Mol. Plant 9, 1302–1314.
【11】Lee, M., Qi, M., and Yang, Y. (2001). A novel jasmonic acid-inducible rice myb gene associates with fungal infection and host cell death. Mol. Plant-Microbe Interact. 14, 527–535.
【12】Yokotani, N., Ichikawa, T., Kondou, Y., Iwabuchi, M., Matsui, M., Hirochika, H., and Oda, K. (2013). Role of the rice transcription factor JAmyb in abiotic stress response. J. Plant Res. 126, 131–139.
【13】Abel, P.P., Nelson, R.S., De, B., Hoffmann, N., Rogers, S.G., Fraley, R.T., and Beachy, R.N. (1986). Delay of disease development in transgenic plants that express the tobacco mosaic virus coat protein gene. Science 232, 738–743.
【14】Hayakawa, T., Zhu, Y., Itoh, K., Kimura, Y., Izawa, T., Shimamoto, K., and Toriyama, S. (1992). Genetically engineered rice resistant to rice stripe virus, an insect-transmitted virus. Proc. Natl. Acad. Sci. U. S. A. 89, 9865–9869.
来源:bioartplants BioArt植物
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3ODY3MDM0NA==&mid=2247495819&idx=1&sn=5f35fff5e16407fa3a1ddd05951fc328&chksm=fd736aecca04e3fae5926c5bbcf17738a069a9a0ca3ed80e5d47bf46110061e5a243e9f04eee&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

昆明动物所等在百岁老人健康长寿保护机制研究中取得进展----中国科学院

杜云龙课题组发现生长素与茉莉酸介导内生真菌定殖于三七与水稻
南京农业大学揭示水稻中BR信号通路与拟南芥不同

郑大农学院李付广团队在茉莉酸信号通路JAZ1蛋白调控棉花耐盐性研究领域取得进展

基因组研究揭示寿星健康保护机制
研究揭示乙烯和茉莉酸信号途径相互应答介导水稻响应刺吸式昆虫的机制

何祖华:和稻瘟病较劲15年
Nature | piRNA信号通路新调控因子
遗传发育所茉莉酸信号通路转录调控机理研究获进展
研究揭示乙烯和茉莉酸信号途径相互应答介导水稻响应刺吸式昆虫的机制