科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-26
来源:逻辑神经科学
动物与复杂的生物群落(包括微生物在内)以共生、致病或互惠的关系共存【1】。一些细菌可以产生具有生物活性的神经递质,之前的一些证据表明,这些神经递质可以调节其宿主神经系统的活动和行为【2-3】。然而,这种微生物-脑信号转导(microbiota-brain signalling)的机制基础和它的生理相关性很大程度上是未知的。
此外,麻省理工学院的Dennis H. Kim教授实验室的一项研究显示:致病菌能够致使秀丽隐杆线虫(Caenorhabditis elegans)的嗅觉行为发生改变【4-5】。但是,其肠道共生细菌是否也能调节宿主行为,我们尚不清楚。
在于2020年6月17日以A neurotransmitter produced by gut bacteria modulates host sensory behaviour为题在线发表在Nature上的文章中,来自美国布兰迪斯大学生物系的Piali Sengupta教授实验室(博士后研究员Michael P. O’Donnell为本文第一作者和通讯作者)报道了共生性肠道细菌产生的神经递质调节宿主的感觉行为。
文章内容简要而言,首先,Michael O’Donnell博士等人发现,在秀丽隐杆线虫(Caenorhabditis elegans)中,一种寄生于肠道的共生菌,即普罗维登斯菌(Providencia bacteria),其所产生的神经调节物酪胺(tyramine)能够绕过了宿主酪胺生物合成的需要,并操纵宿主的感官行为决定。
作者进一步发现,该细菌产生的酪胺可能被宿主酪胺β-羟化酶转化为章鱼胺(octopamine),而章鱼胺能够靶定ASH伤害性神经元(ASH nociceptive neurons),即ASH感觉神经元上的OCTR-1章鱼胺受体,进而来调节厌恶性嗅觉反应(aversive olfactory response)【注:ASH是一组纤毛神经元,这些纤毛神经元属于头感器(amphid sensilla)的一部分,而头感器则是纽虫类的化学感受器之一【6】】。
而且,Michael O’Donnell等人也鉴定了在普罗维登斯菌中合成酪氨所需的基因,比如tyrDC、adcA等基因,并表明了这些基因是调节宿主行为所必需的。
最后,研究人员发现,在食物选择试验中,移植有普罗维登斯菌的线虫会优先选择这些细菌作为食物,而且,这种选择偏好性需要细菌产生的酪胺和宿主章鱼胺信号转导。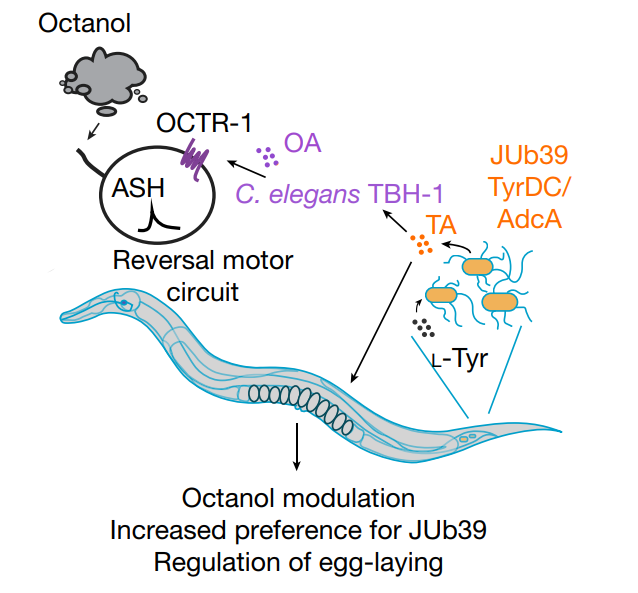
文章模型图
(JUb39:一种产碱罗维登斯菌(Providencia alcalifaciens strain);OA:章鱼胺;TA:酪胺)
(图片引自:O’Donnell, M.P., et al., Nature 2020)
文章结论总的来说,Michael O’Donnell等人这项研究表明:天然共生性肠道细菌产生一种神经递质,并通过补充或补偿关键的宿主生物合成酶的活性来指导宿主感觉行为决定,从而改变宿主和微生物的适应性。原文链接:
https://doi.org/10.1038/s41586-020-2395-5
参考文献
【1】Douglas, A. E. Fundamentals of Microbiome Science: How Microbes Shape Animal Biology (Princeton Univ. Press, 2018).
【2】Guo, R., Chen, L.-H., Xing, C. & Liu, T. Pain regulation by gut microbiota: molecular mechanisms and therapeutic potential. Br. J. Anaesth. 123, 637–654 (2019).
【3】Strandwitz, P. Neurotransmitter modulation by the gut microbiota. Brain Res. 1693 (Pt B), 128–133 (2018).
【4】Schulenburg, H. & Félix, M.-A. The natural biotic environment of Caenorhabditis elegans. Genetics 206, 55–86 (2017).
【5】Meisel, J. D. & Kim, D. H. Behavioral avoidance of pathogenic bacteria by Caenorhabditis elegans. Trends Immunol. 35, 465–470 (2014)
【6】Chao, M. Y., Komatsu, H., Fukuto, H. S., Dionne, H. M. & Hart, A. C. Feeding status and serotonin rapidly and reversibly modulate a Caenorhabditis elegans chemosensory circuit. Proc. Natl Acad. Sci. USA 101, 15512–15517 (2004)
来源:LT-Neuroscience 逻辑神经科学
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4Mjk3NzUxOQ==&mid=2247486936&idx=2&sn=6604f07d9219566716f75d6b2ad86367&chksm=eb90f858dce7714e4b08ddf873a71f308f6078d6e8a39c07a05fd4fea37ffff99beb3bd072b8#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
科学家首次观测到小鼠免疫系统识别入侵细菌全过程

Nature Video:虚拟现实会是神经科学研究的未来吗?

神经科学可以预测自杀吗?
神经科学:睡前消消气

自然中不存在的蛋白质也能人造了!撼动材料医药界

口腔与细菌性肠疾的关系被揭示
遗传学: 杀手是怎样炼成的

奖项申请 | 张香桐神经科学青年科学家奖/张香桐神经科学优秀研究生论文奖

神经科学揭秘鲨鱼放电原理
Nature:AI与神经科学再现模拟大脑