科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-11
2020年7月8日,上海科技大学免疫化学研究所特聘教授饶子和院士与昆士兰大学教授兼免化所访问教授Luke Guddat的联合科研团队在国际顶尖学术期刊《Nature》发表论文。
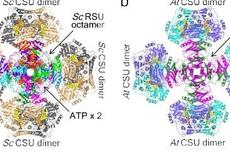
该项工作在国际上首次成功解析了植物和真菌的乙酰羟基酸合成酶的完整三维结构。乙酰羟基酸合成酶(AHAS)是目前世界范围广泛用于水稻、小麦和大麦作物的50多种商用除草剂的靶标,也是针对人类结核病致病菌(结核分枝杆菌)和侵袭性真菌病原体(白色念珠菌等)的新靶标。与抗生素一样,除草剂(包括那些作用方式是AHAS的除草剂)的抗药性问题逐渐产生并引发广泛关注。因此,阐明这一重要催化酶的作用机制迫在眉睫。

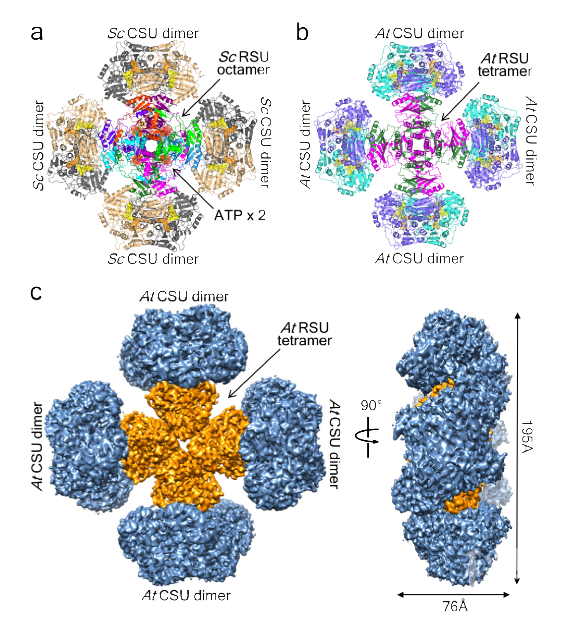
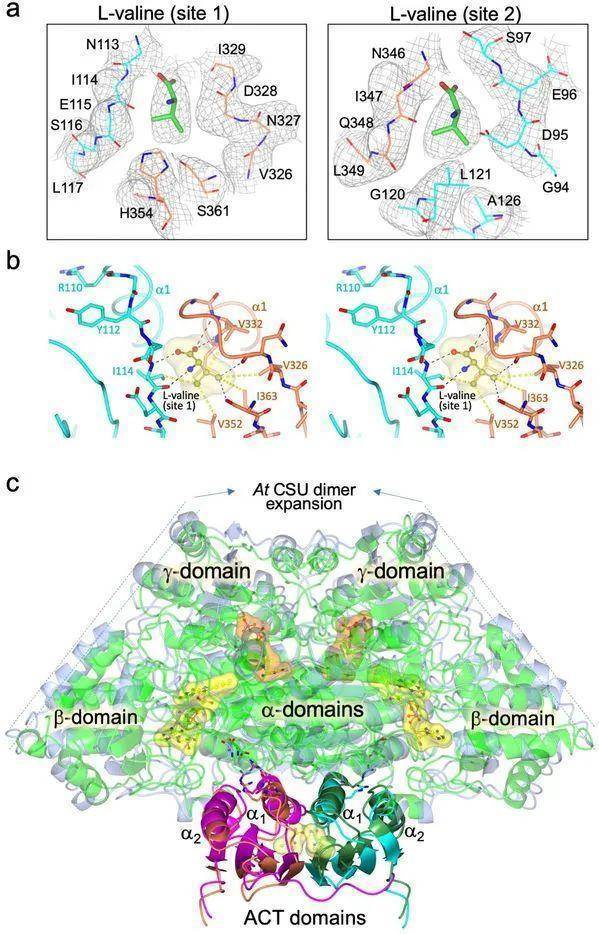 图2:结合位点的相互作用,以及AtRSU中L-缬氨酸以及L-缬氨酸结合后的冷冻电镜图。
图2:结合位点的相互作用,以及AtRSU中L-缬氨酸以及L-缬氨酸结合后的冷冻电镜图。来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247511793&idx=6&sn=833daa8e8ecb59e22a46773f7cfcc014&chksm=fce6dd2ecb91543827e82fefd73bbcb45673869865470b23cf486015c72a2c59a6af8ec0c02e#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
武汉大学今日Nature;华大基因Nature
JACS:具有高强度和延展性的聚(α-羟基酸)的手性序列可控合成

化学生物学:含5-羟基色胺酸为第21种氨基酸的大肠杆菌的构建及应用
更好的期刊,更好的科学——中国科技峰会·世界科技期刊论坛专家观点荟萃



Nature论文称,替代新烟碱的杀虫剂仍会伤害蜂群
六羟基锑酸钾

大连化物所实现木质纤维素生物炼制高效合成脂肪酸和3-羟基丙酸

羟基锡酸钴在软质聚氯乙烯中的高效阻燃消烟作用
上科大饶子和等团队解析植物和真菌的乙酰羟基酸合成酶结构
华侨大学博士生首次在Nature发文


