科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-15
来源:华东师范大学
通过感光元器件实现对事物的控制,这次被光操控的是基因编辑。FAST系统不仅在体外培养的多种哺乳动物细胞中实现了内源基因的光控基因编辑,而且可以对动物体内的成体细胞实现光控基因编辑。
“该系统对小鼠肿瘤中的致癌基因进行光控编辑,实现了通过LED发出的远红光(730 nm)照射抑制肿瘤生长。”叶海峰说。
7月10日,《科学》子刊《科学-进展》(Science Advances)在线发表了这一最新研究成果。
近年来新兴的第三代基因编辑技术——CRISPR-Cas9,既保证了良好的打靶效率,又更加简便、快捷、高效,且成本也大大降低,该技术几乎可以在任何物种的任何位置发挥作用,广受科学界瞩目,成为生命科学史上具有里程碑意义的生物技术。
然而,传统的CRISPR-Cas9系统存在较大的免疫原性以及不可控性产生脱靶效应,带来严重、不可预估的副作用;此外,也无法实现时空特异性的精准基因编辑,不能满足人们的应用需求。
为了解决以上科学问题,该研究以低强度的远红光外部照射作为控制手段,借助于远红光本身的组织器官通透性高优势,能够在时间和空间上特异性的精准控制体内深层组织和器官的基因编辑。
通俗地说,就是给传统的CRISPR-Cas9系统加上远红光控制“开关”,只有远红光照射时,系统才可以工作,从而极大地降低脱靶效应,并利用光控技术本身的优势实现时空特异性的精准基因编辑。
这项精准、时空可控的FAST系统是叶海峰研究团队巧妙利用合成生物学、光遗传学、基因编辑等多学科技术交叉手段,将红细菌中响应远红光的蛋白BphS,链球菌中的转录因子BldD以及酿脓链球菌中的Cas9核酸酶经理性设计、组装和重编程而成的远红光调控的分割型split-Cas9基因编辑系统,其中Cas9核酸酶被分为N端(第1-713个氨基酸)和C端(第714-1368个氨基酸)两部分,分别融合了来自热纤维梭菌的一对能够自发相互结合的蛋白Coh2和DocS。
只有当Cas9(N)-Coh2和DocS-Cas9(C))两种融合蛋白均表达完成时,N端Cas9和C端Cas9可以在Coh2和DocS的自发相互作用下结合到一起,形成有功能的完整Cas9核酸酶,从而发挥基因编辑功能。这种在细胞内短暂形成完整基因编辑功能的复合物形式,可以很大程度上减少Cas9蛋白带来的一系列副作用。
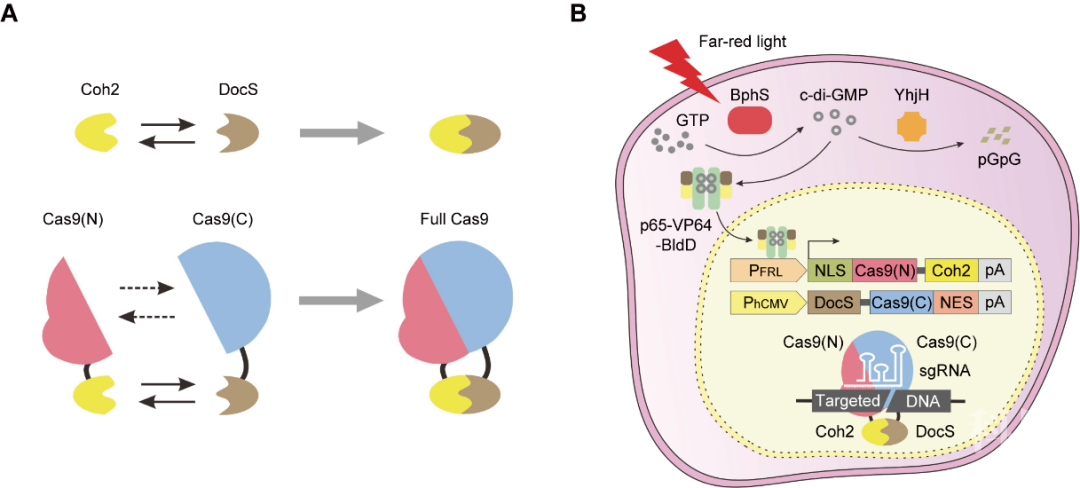
远红光调控的分割型split-Cas9基因编辑系统(FAST系统)的设计原理示意图
研究结果显示,FAST系统在LED发射的低强度远红光照射下可以诱导细胞内单个或多个内源基因的编辑。并且,FAST系统在多种细胞中均显示出可调控的基因编辑效果,并具有良好的光照强度、光照时间依赖性,以及高度的时空特异性。
鉴于FAST系统在体外研究中展现出的高度可控性,研究人员将该系统应用于以下两种模型小鼠中,进一步验证FAST系统的体内应用潜力:
Ø在tdTomato(一种红色荧光蛋白)转基因报告模型小鼠体内测试FAST系统在小鼠肝脏成体细胞中的基因编辑情况。通过流体动力学尾静脉注射方式将FAST系统递送至转基因报告小鼠的肝脏中,只有当完整功能的Cas9对loxP-STOP-loxP终止信号区域的DNA进行编辑后,tdTomato红色荧光蛋白才能被表达出来。因而,通过观察小鼠肝脏部位tdTomato的表达情况可以得知肝脏细胞中DNA被编辑的情况。肝脏器官成像和组织冰冻切片结果显示:相比于黑暗对照组,光照组小鼠肝脏中的tdTomato基因有显著的表达。
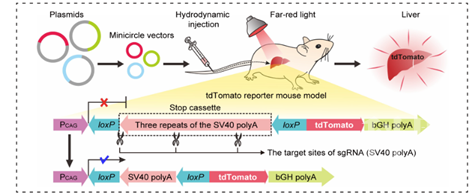
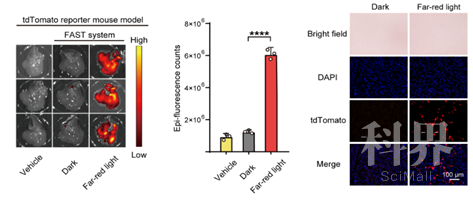
FAST系统介导的在tdTomato转基因报告小鼠[Gt(ROSA)26Sortm14(CAG-tdTomato)Hze]中的基因编辑
Ø在异种移植肿瘤(A549)模型小鼠中验证了FAST系统的疾病治疗应用潜力。将FAST系统递送至小鼠体内的肿瘤中,通过远红光的照射使得FAST系统切割肿瘤致癌基因PLK1即可显著抑制肿瘤的生长。两种模型小鼠体内的研究结果均证明FAST系统仅需使用低强度的远红光LED外部照射即具有良好的可调控体内基因编辑效果。
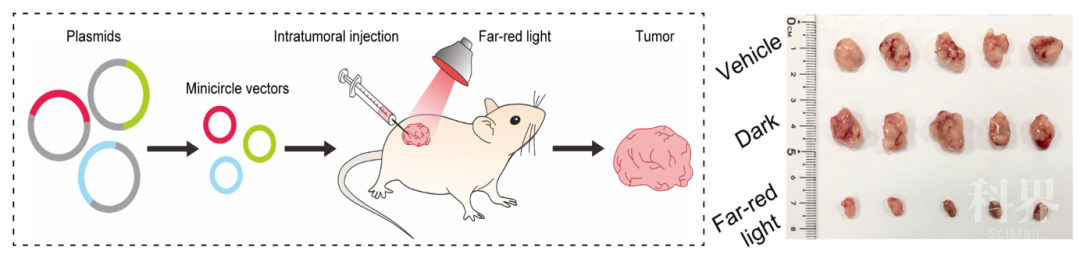
在异种移植肿瘤(A549)小鼠模型中,通过FAST系统介导基因编辑抑制肿瘤生长
总之,FAST系统展现出了远程无痕、低本底泄露,低脱靶效应,低毒性,高度时空特异精准性以及强组织穿透性等体内应用优势。这项研究作为一个精准、时空可控的基因编辑技术平台,提供了一种新型可控的基因编辑工具,扩展了当前CRISPR-Cas9基因编辑工具箱,有望应用于基因功能的研究,以及遗传病、肿瘤等多种疾病的精准可控治疗。该研究受到了国家重点研发计划“合成生物学”重点专项、国家自然科学基金、上海市科委合成生物学重大项目的资助。
来源:ECNUers 华东师范大学
原文链接:https://mp.weixin.qq.com/s?__biz=MjM5MzY4NTMwMQ==&mid=2651073916&idx=1&sn=50b4a96d242c5918f5b4a061f30f4431&chksm=bd63c7268a144e300302f8b61178f5fab44047d1e397175790681bd2b66fe766bb6b8c7d5178#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
基因工程方法培育出人类迷你肝脏

蚊子怕怕了,利用转基因能破坏它们生育能力,必死无疑

材料基因工程加速新材料研发

生物技术
生物技术:制造新肠道

分会介绍 | E06-材料基因工程
同样搞基因编辑,贺建奎 黄军就何以评价两极化


编辑基因创造超人,霍金的担心是不是杞人忧天




中国科学家培育出基因编辑瘦肉猪:脂肪少24%
大师谈动画版:基因工程