科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-22
来源:iPlants
2020年7月20日,Nature Plants杂志在线发表美国德州农工大学张秀任教授和浙江大学王智烨研究员为通讯作者,题为“Degradation of SERRATE via ubiquitin-independent 20S proteasome to survey RNA metabolism”的研究论文。
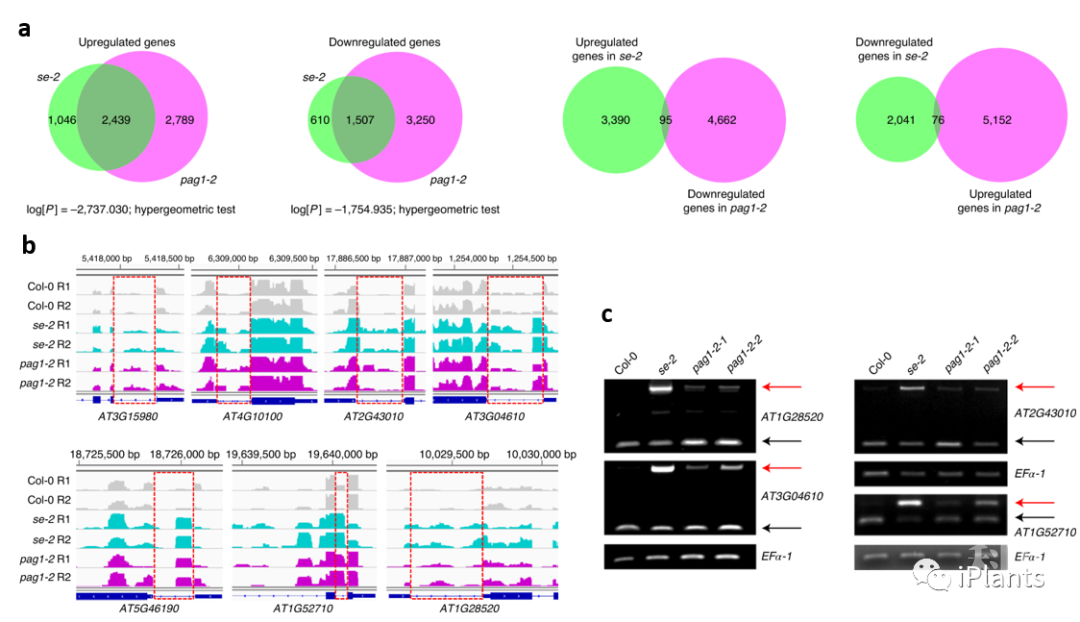 图1. PAG1是SE 功能的正调控因子。
图1. PAG1是SE 功能的正调控因子。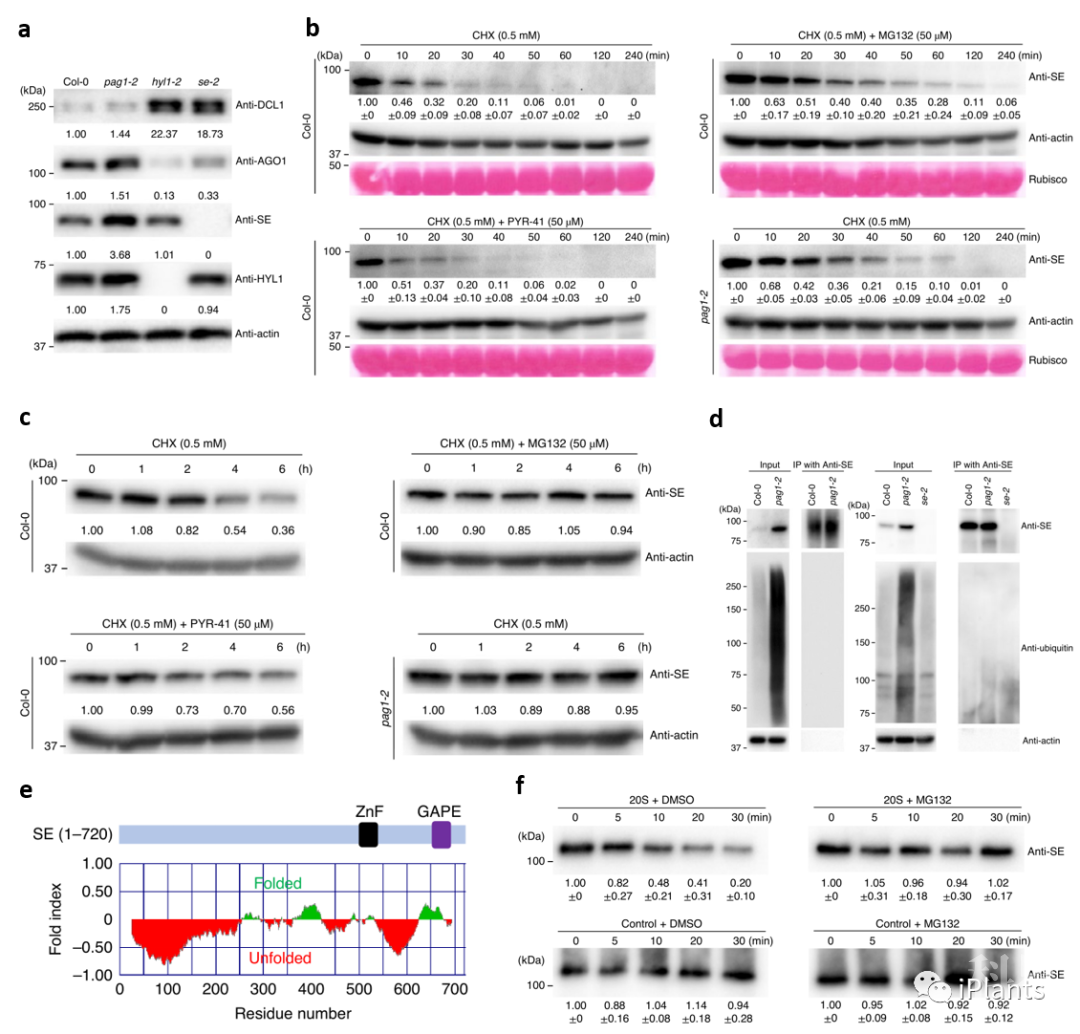 图2. SE蛋白受PAG1 介导的非泛素依赖的20S蛋白酶体降解。
图2. SE蛋白受PAG1 介导的非泛素依赖的20S蛋白酶体降解。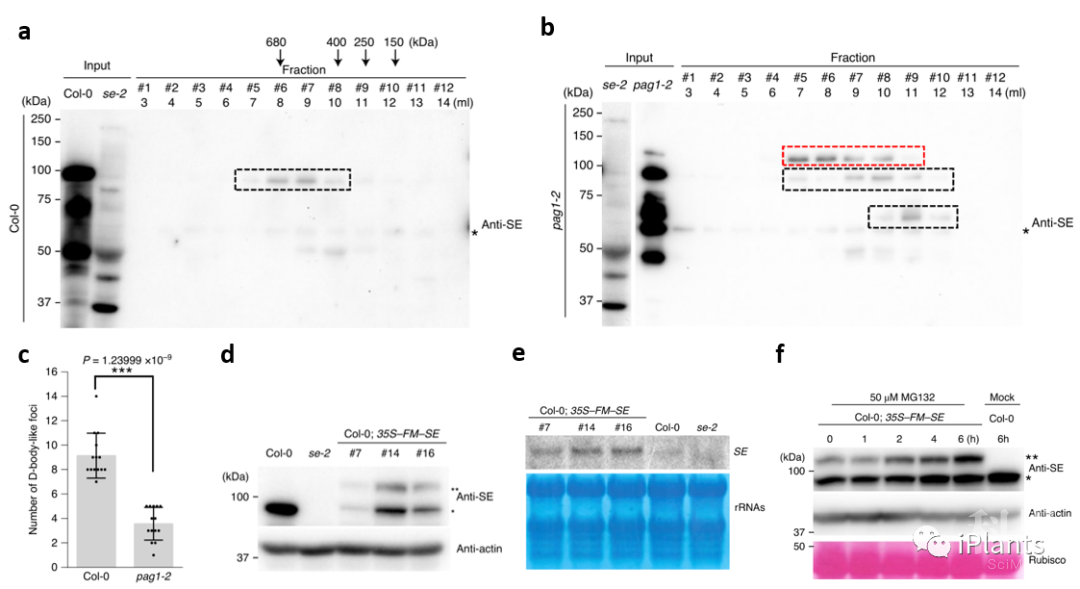 图3. 超积累的无序SE蛋白阻碍SE蛋白与其互作蛋白形成大分子蛋白复合体。
图3. 超积累的无序SE蛋白阻碍SE蛋白与其互作蛋白形成大分子蛋白复合体。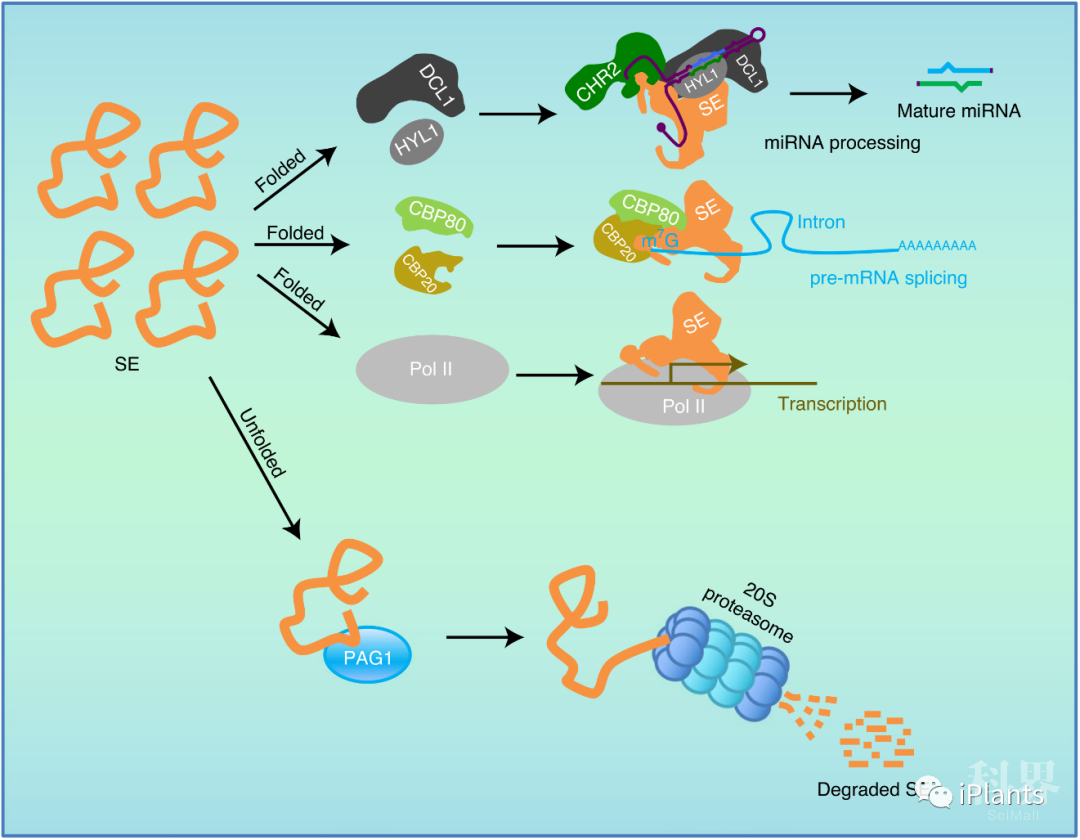 图4. 20S蛋白酶体通过PAG1介导的SE蛋白降解来维持体内RNA代谢稳态。
图4. 20S蛋白酶体通过PAG1介导的SE蛋白降解来维持体内RNA代谢稳态。来源:PlantRSS iPlants
原文链接:https://mp.weixin.qq.com/s?__biz=MzUzNzczODE4Mg==&mid=2247498030&idx=2&sn=496d2d6948d1a6dd678184f03bf461dd&chksm=fae0d787cd975e91b795ec1ca97d5459eac94b621788c1b60ed738f57655e5693d893c742f5d#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
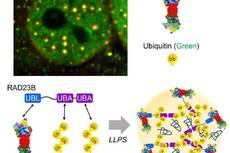
《Nature》泛素化水平升高,推动蛋白酶体相分离形成
一个小小的细胞就有多达4200万个蛋白质分子

【大师讲堂】蛋白酶体研究:为癌症靶向治疗提供新思路
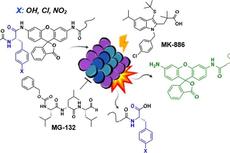
非天然氨基酸增强型荧光探针用于蛋白酶体的活性检测
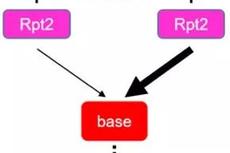
PNAS:郭行团队揭示26S蛋白酶体新调控机制

天价冬虫夏草能否抗癌成“罗生门”

Dev Cell : 刘凯博士等阐明蛋白酶体转运的分子机理和生理意义
从健康细胞到癌细胞,或许只需要几个突变

学术造假必遭严惩,为何仍不断有人冒险

【学会动态】第三届泛素-蛋白酶体与细胞稳态调控研讨会在南方科技大学召开